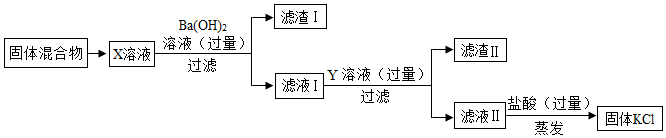
题目内容
11.现有某不纯的碳酸钠固体样品,已知其中含有的杂质可能是Na2SO4、CuSO4、NaCl、CaCl2中的一种或几种.为确定其杂质的成分,进行如下实验,出现的现象如图所示(设过程中所有发生的反应都恰好完全进行).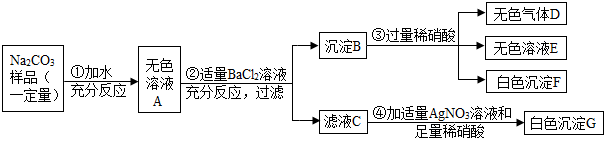
请你根据实验过程和发生的现象做出分析判断,填写以下空白:
(1)把气体D通入紫色石蕊溶液中,观察到的现象是石蕊试液变红.白色沉淀F的化学式是BaSO4.
(2)碳酸钠固体样品中一定含有的杂质是Na2SO4(写化学式).
(3)无色溶液E中共存在2种溶质.
(4)请写出过程④中发生反应的化学方程式:BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2.
(5)碳酸钠固体样品中还不能确定的物质是NaCl(写化学式),要确定它是否存在,可用溶液A再实验.请简述你的设计方案(说明实验操作步骤、发生的现象及结论)在A溶液中加入适量硝酸钡溶液,然后过滤,向滤液中加入适量硝酸银溶液和稀硝酸,若有白色沉淀,则说明含有氯化钠.
分析 根据题干提供的信息进行分析,样品加水得无色溶液,硫酸铜的水溶液是蓝色的,则一定不含有硫酸铜;加入氯化钡溶液产生了沉淀B,由于碳酸钠能与氯化钡反应生成碳酸钡沉淀,硫酸钠能与氯化钡反应生成硫酸钡沉淀,加入稀硝酸得到了无色气体D,则D是二氧化碳,白色沉淀F是硫酸钡,在滤液C中加入硝酸银溶液,生成了不溶于稀硝酸的白色沉淀G,则G是氯化银,说明C中含有氯离子,此步骤是想证明A中含有氯化钠,但是由于步骤②加入的是氯化钡,故不能说明含有氯化钠,据此解答即可.
解答 解:样品加水得无色溶液,硫酸铜的水溶液是蓝色的,则一定不含有硫酸铜,由于氯化钙能与碳酸钠反应生成碳酸钙沉淀,故一定不含有氯化钙;加入氯化钡溶液产生了沉淀B,由于碳酸钠能与氯化钡反应生成碳酸钡沉淀,硫酸钠能与氯化钡反应生成硫酸钡沉淀,加入稀硝酸得到了无色气体D,则D是二氧化碳,白色沉淀F是硫酸钡,在滤液C中加入硝酸银溶液,生成了不溶于稀硝酸的白色沉淀G,则G是氯化银,说明C中含有氯离子,此步骤是想证明A中含有氯化钠,但是由于步骤②加入的是氯化钡,故不能说明含有氯化钠,
(1)D是二氧化碳,二氧化碳溶于水生成碳酸,碳酸呈酸性,能使石蕊试液变红,白色沉淀F是硫酸钡,故填:石蕊试液变红,BaSO4;
(2)碳酸钠样品中一定含有硫酸钠,故填:Na2SO4;
(3)无色溶液E是碳酸钡和过量的稀硝酸反应产生的硝酸钡和过量的稀硝酸形成的溶液,故填:2;
(4)过程④中加入氯化钡溶液一定会与硝酸银溶液反应生成氯化银沉淀和硝酸钡,故填:BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2;
(5)碳酸钠样品中不能确定存在的物质是氯化钠,若要检验其是否存在,可以在A溶液中加入适量硝酸钡溶液,然后过滤,向滤液中加入适量硝酸银溶液和稀硝酸,若有白色沉淀,则说明含有氯化钠,故填:NaCl,在A溶液中加入适量硝酸钡溶液,然后过滤,向滤液中加入适量硝酸银溶液和稀硝酸,若有白色沉淀,则说明含有氯化钠.
点评 本题考查了混合物成分的推断,完成此题,可以依据物质的性质结合物质间反应的实验现象进行.要求同学们加强对基础知识的储备,以便灵活应用.

 阅读快车系列答案
阅读快车系列答案| A. | 碳、一氧化碳和二氧化碳都能还原氧化铜 | |
| B. | 一氧化碳、二氧化碳均为大气污染物 | |
| C. | 二氧化碳能使干燥的石蕊纸花变红 | |
| D. | 二氧化碳灭火同时利用了它的物理性质和化学性质 |
请从A或B两题中任选1个作答,若两题均作答,按A计分.
| A | B |
| 丙酸钠是一种常用的防腐剂,其化学式为C3H5O2Na.碳元素和氧元素的质量比为9:8. | 山梨酸钾(C6H7KO2)是国际粮农组织和卫生组织推荐的高效安全的防腐保鲜剂. 山梨酸钾中钾质量分数为26%,其计算式为$\frac{39}{12×6+1×7+39+16×2}×100%$. |
请从24-A或24-B两题中任选1个作答,若两题均作答,按24-A计分.
| 24-A | 24-B |
| (1)图A为实验室电解水实验的装置图,a试管中产生的气体为氢气. (2)自然界中的水需净化后饮用,活性炭常用于净化水,其主要作用是吸附. (3)在电解水时用氢氧化钠溶液増强导电性,其溶剂是水. 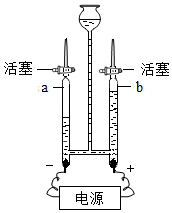 A | (1)电解水的示意图中,正极和负极产生气体的体积比为1:2. (2)图B为简易净水器和电解水的示意图,用此净水器净化后的水是混合物(填纯净物或混合物). (3)在电解水时用稀硫酸増强导电性,稀硫酸中的溶剂是水. 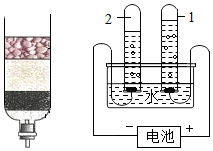 B |
 甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答:
甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答: