题目内容
18.将铜和氧化铜混合物粉末11.2g放入烧杯中,当加入稀硫酸100g时,氧化铜与硫酸恰好完全反应,过滤后所得的质量为108g.(结果精确到0.1)(1)铜不能(填“能”或“不能”)与稀硫酸反应,因为金属活动性顺序中铜排在氢的后面.
(2)求原混合物中铜的质量.
(3)求反应后滤液中溶质的质量分数.
分析 氧化铜和稀硫酸反应生成硫酸铜和水,反应前后的质量差即为混合物中铜的质量,根据铜的质量可以计算氧化铜的质量,进一步可以计算反应生成硫酸铜的质量及其反应后滤液中溶质的质量分数.
解答 解:(1)铜不能与稀硫酸反应,因为金属活动性顺序中铜排在氢的后面.
故填:不能;金属活动性顺序中铜排在氢的后面.
(2)原混合物中铜的质量为:11.2g+100g-108g=3.2g,
答:原混合物中铜的质量为3.2g.
(3)设反应生成硫酸铜质量为x,
氧化铜质量为:11.2g-3.2g=8g,
CuO+H2SO4═CuSO4+H2O,
80 160
8g x
$\frac{80}{8g}$=$\frac{160}{x}$,
x=16g,
反应后滤液中溶质的质量分数为:$\frac{16g}{108g}$×100%=14.8%,
答:反应后滤液中溶质的质量分数为14.8%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案
相关题目
5.下列几种常见的饮料中,不含有机物的可能是( )
| A. | 矿泉水 | B. | 果汁 | C. | 牛奶 | D. | 啤酒 |
6.物质能在空气中燃烧并发出白光的是( )
| A. | 碳 | B. | 镁带 | C. | 铁 | D. | 硫 |
3.下列主题知识的归纳中,正确的一组是( )
| A.生活常识 | B. 安全常识 |
| 用铁锅烹调食物→防止贫血 亚硝酸钠(NaNO2)→有咸味可用于腌制食品 | 煤气泄漏→先打开排气扇 高楼室内起火→立即打开所有门窗呼吸 |
| C.化学与社会 | D.环保知识 |
| 玻璃钢、塑料、涤纶→合成材料 红烧排骨、清蒸鲈鱼→富含蛋白质 | 减缓温室效应→植树造林节能减排 减少白色污染→使用可降解塑料 |
| A. | A | B. | B | C. | C | D. | D |
10.下列图象能正确反映其对应的实验操作的是( )
| A. |  常温下向pH=10的NaOH溶液中不断加入水稀释 | |
| B. |  向等质量的Mg和MgO中分别加入足量等浓度的稀硫酸 | |
| C. | 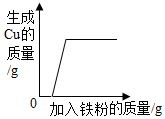 向一定量的Zn(NO3)2和Cu(NO3)2的混合溶液中不断加入铁粉 | |
| D. | 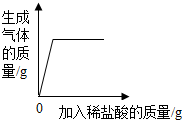 向一定量的部分变质的氢氧化钠溶液中滴加足量的稀盐酸 |
8.下列说法中正确的是( )
| A. | 人体胃液正常的pH范围在0.9~4.5 | |
| B. | 仅仅是为了防止水污染,农业上要合理使用化肥、农药 | |
| C. | 鲜艳颜色的植物和花朵均可制成酸碱指示剂 | |
| D. | 世界上没有真正的垃圾,只有放错地方的资源 |
