题目内容
16.下列框图中的物质均为中学化学常见物质,其中A是大理石的主要成分,B、D是金属氧化物,H是蓝色沉淀.如图是它们之间的转化关系,请回答.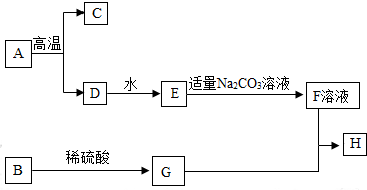
(1)写出B物质的化学式:CuO;H属于碱(选填“氧化物”、“酸”、“碱”或“盐”).
(2)D俗称生石灰;与水反应属于放热反应(填“吸热”或“放热”).
(3)写出物质E的一种用途改良酸性土壤等(合理即可).
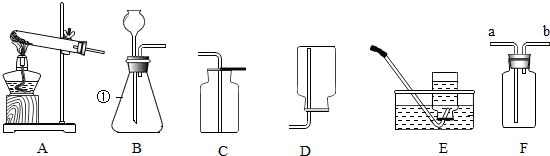
(4)仪器①的名称是锥形瓶.实验室制取C物质的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑;制取并收集C物质应选择下图中bc;若用f装置来收集C物质应从a(“a”或“b”)端通入.
分析 (1)根据A是大理石的主要成分,所以A就是碳酸钙,A在高温下又会生成C和D,D能够和水反应产生,E能够和碳酸钠溶液反应,所以D就是氧化钙,氧化钙和水生成氢氧化钙,E就是氢氧化钙,氢氧化钙和碳酸钠生成碳酸钙沉淀和氢氧化钠,所以F就是氢氧化钠,C就是二氧化碳;B是黑色粉末,H是蓝色沉淀,因此B是氧化铜,氧化铜和硫酸反应产生硫酸铜和水,硫酸铜和F反应产生氢氧化铜沉淀,因此F是氢氧化钠溶液,据此完成相关的问题;
(2)根据识记的知识直接写出仪器的名称;碳酸钙为固体,稀盐酸为液体,该反应在常温下进行,可以据此选择发生装置;根据二氧化碳的水溶性和密度来选择收集装置.
解答 解:A是大理石的主要成分,所以A就是碳酸钙,A在高温下又会生成C和D,D能够和水反应产生,E能够和碳酸钠溶液反应,所以D就是氧化钙,氧化钙和水生成氢氧化钙,E就是氢氧化钙,氢氧化钙和碳酸钠生成碳酸钙沉淀和氢氧化钠,所以F就是氢氧化钠,C就是二氧化碳;B是黑色粉末,H是蓝色沉淀,因此B是氧化铜,氧化铜和硫酸反应产生硫酸铜和水,硫酸铜和F反应产生氢氧化铜沉淀,因此F是氢氧化钠溶液,带入验证符合转化关系,因此:
(1)B是氧化铜,H是氢氧化铜,属于碱;故填:CuO;碱;
(2)D是氧化钙,俗名生石灰,和水反应会放出大量的热;故填:生石灰;放热;
(3)E是氢氧化钙,可以用于改良酸性土壤等;故填:改良酸性土壤等(合理即可);
(4)图中所给仪器的名称为:锥形瓶;实验室制取二氧化碳的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑;碳酸钙为固体,稀盐酸为液体,该反应在常温下即可进行,因此发生装置为b,二氧化碳的密度比空气大,可溶于水,所以应该选择向上排空气法收集;用f装置,应该从长管进;
故填:锥形瓶;CaCO3+2HCl═CaCl2+H2O+CO2↑;bc;a.
点评 本题为框图式推断题,解题关键是找准解题的突破口,并从突破口出发,探求知识间的内在联系,应用多种思维方式,进行严密的分析和逻辑推理,推出符合题意的结果.

| A. | 碳铵、碳酸氢铵、NH4HCO3 | B. | 纯碱、碳酸钠、Na2CO3 | ||
| C. | 生石灰、氢氧化钙、Ca(OH)2 | D. | 苛性钠、氢氧化钠、NaOH |
| A. | 化学性质稳定 | B. | 它是一种固体燃料 | ||
| C. | 需要密封保存 | D. | 可用于干燥二氧化碳气体 |
| A. | P→P2O5 | B. | H2O2→H2O | C. | Fe2O3→FeCl2 | D. | Na2CO3→NaCl |
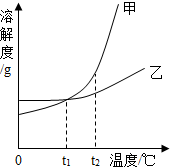
| A. | t1℃时,甲和乙溶液中溶质的质量分数一定相等 | |
| B. | t2℃时,分别用等质量的甲和乙固体,完全溶解配制成饱和溶液,得到乙溶液的质量大于甲 | |
| C. | 将甲、乙的饱和溶液从t1℃升温至t2℃,甲溶液中溶质的质量分数比乙大 | |
| D. | 使甲的不饱和溶液变成饱和溶液只能用降温的方法 |
| A. | 用点燃的方法除去CO2中的CO | |
| B. | 用生石灰除去二氧化碳中的水蒸气 | |
| C. | 用水鉴别NH4NO3和NaOH固体 | |
| D. | 用硝酸银溶液鉴别氯化钠溶液和稀盐酸 |

