题目内容
16.金属及合金的性质具有多样性,它们是一类应用广泛的材料.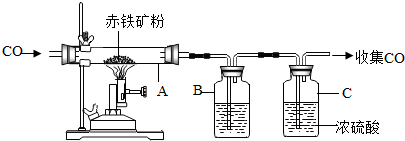
(1)铝是地壳中含量最多的金属元素,铝可以制成铝箔,这是利用了金属的延展性.
(2)铁是用量最大的金属,工业上以赤铁矿(主要成分为Fe2O3)为原料,用一氧化碳将其还原而得到金属铁,实验室模拟工业炼铁的装置如图所示:
A中可以观察到的现象是红色固体变黑色,反应的化学方程式为3CO+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;将反应后的气体通过装置B和C,收集较纯净的CO并循环使用,B中应盛放的试剂是氢氧化钠(或NaOH)的浓溶液.
(3)生铁和普通钢都是铁合金,除铁外,它们所含的另一种相同的元素是碳.生铁和普通钢在性质上存在差异的主要原因是含碳量不同.
(4)单质铁可用来回收某些金属.
将过量铁粉加入到含有硝酸铜、硝酸银、硝酸锌的某工业废水中,所发生反应的化学方程式是Fe+2AgNO3=Fe(NO3)2+2Ag、Fe+Cu(NO3)2═Fe+Cu(NO3)2(假设其他物质不参与反应).
为了除去过量的铁,还要将得到的固体物质在过量的稀盐酸中浸泡,并进行分离操作,该操作的名称是过滤,此过程中发生反应的化学方程式是Fe+2HCl=FeCl2+H2↑.
分析 (1)根据物质的用途与性质来分析;
(2)根据氧化铁反应后生成铁的颜色变化分析,依据反应的事实结合反应方程式书写的原则方程式的书写,根据反应生成二氧化碳考虑气体的除杂问题;
(3)根据已有的生铁和钢的知识进行分析解答即可;
(4)根据四种金属活动性强弱关系:锌>铁>H>铜>银,在硝酸银和硝酸铜、硝酸锌的混合溶液中,加入一定量的铁粉,铁能与硝酸银、硝酸铜依次发生反应.将固体与液体分离使用过滤的方法.
解答 解:(1)铝可以制成铝箔,这是利用了金属的延展性;故填:延展性;
(2)实验室炼铁,A中发生反应是,一氧化碳把三氧化二铁还原为铁,并生成二氧化碳气体,现象是:红色固体变黑色;化学反应方程式是:3CO+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;收集较纯净的一氧化碳要除去反应生成的二氧化碳和水蒸气,把气体通入盛放氢氧化钠溶液的试剂瓶,除去二氧化碳,再通入浓硫酸干燥气体;故填:红色固体变黑色;3CO+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;氢氧化钠(或NaOH);
(3)生铁和钢都是铁的合金.它们性能存在差异的主要原因是由于其含碳量不同,故填:碳;含碳量;
(4)在硝酸银和硝酸铜的混合溶液中,加入一定量的铁粉,铁能与硝酸银、硝酸铜依次发生反应,因此一定会发生的反应是铁和硝酸银反应产生硝酸亚铁和银,铁与硝酸铜反应生成铜和硝酸亚铁;将铁粉、铜粉和银粉的混合物分离可加入过量的稀盐酸,铁粉充分反应,而银粉和铜粉与之不反应,然后过滤即可.
故填:Fe+2AgNO3=Fe(NO3)2+2Ag;Fe+Cu(NO3)2═Fe+Cu(NO3)2;过量的稀盐酸;过滤;Fe+2HCl=FeCl2+H2↑.
点评 本题主要考查了对金属活动性顺序的灵活应用,只有活动性强的金属可以把活动性弱的金属从盐溶液中置换出来,培养学生分析问题、解决问题的能力.

 阅读快车系列答案
阅读快车系列答案| A. | 过氧乙酸分子是由碳、氢、氧三种元素组成的 | |
| B. | 过氧乙酸分子中含有氧气分子 | |
| C. | 一个过氧乙酸分子是由二个碳原子、三个氧原子、四个氢原子构成 | |
| D. | 过氧乙酸相对分子质量计算式是12+1+12+16+16+16+1 |
| A. |  向10mL量筒中加水接近8mL | B. |  再用滴管滴水至8mL | ||
| C. |  把水加入浓硫酸中 | D. |  搅拌 |
| A. | 用水检验无水硫酸铜、碳酸氢钠和硫酸钡粉末 | |
| B. | 不用外加试剂检验氯化铁溶液,氢氧化钠溶液和氯化钠溶液 | |
| C. | 用硫酸钠溶液区分稀盐酸、氯化钙溶液和稀硝酸 | |
| D. | 用紫色石蕊溶液区分氢氧化钠溶液、氯化钠溶液和盐酸 |
| A. | 胆矾研细 | B. | 石墨变金刚石 | C. | 灯泡发光 | D. | 冰雪融化 |
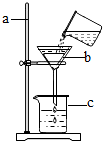 如图是某同学用来除去水中难溶性杂质时所采用的过滤装置图.试回答:
如图是某同学用来除去水中难溶性杂质时所采用的过滤装置图.试回答:
 .
. 乙醇是一种环境友好的有机溶剂.
乙醇是一种环境友好的有机溶剂.