题目内容
12.学习了金属活动性表后,卓嘎同学做了以下实验:(1)探究Fe、Cu、Ag三种金属的活动顺序
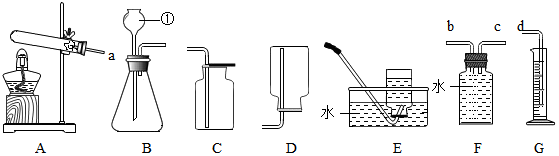
①她设计了四个方案,其中你认为不可行的是D.
A.Fe、Ag、CuSO4溶液 B.Fe、Cu、AgNO3溶液、稀盐酸
C.Cu、FeCl2溶液、AgNO3溶液 D.Cu、Ag、Fe、稀盐酸
②写出上述C方案中发生反应的化学方程式Cu+2AgNO3═Cu(NO3)2+2Ag.
(2)将铁粉加入盛有ZnSO4和CuSO4混合溶液的烧杯中,充分反应后过滤,在滤渣中滴入稀盐酸,有气泡产生.据此判断,滤渣中含有铜、铁;滤液中的溶质是ZnSO4、FeSO4
(写化学式);滴加盐酸时的反应方程式为Fe+2HCl═FeCl2+H2↑;.
分析 根据金属活动顺序进行思考,Ag、Fe、Cu这三种金属的金属活动性由强到弱的顺序为Fe>Cu>Ag.在金属活动顺序表中,前边的金属可以把后边的金属从其盐溶液中置换出来,所以可以选择相应的金属和盐溶液进行反应来证明这三种金属的活动性强弱.
解答 解:(1)A、Fe、Ag、CueSO4溶液这三种物质中,Fe与CuSO4溶液反应,证明铁的活动性比铜强,Ag与CuSO4溶液不能反应,证明铜比银的活动性强.所选试剂组可行.
B、Fe和稀盐酸反应,得出Fe>H.而Cu不能与稀盐酸反应,所以Fe>Cu,Cu与硝酸银反应,所以Cu>Ag;所以可以得出:Fe>Cu>Ag.所选试剂组可行.
C、Cu、FeCl2溶液、AgNO3溶液这三种物质中,Cu与FeCl2溶液不反应,证明铁的活动性比铜强,Cu与AgNO3溶液能反应,证明铜比银的活动性强,可以证明三种金属的活动性强弱,此试剂组可行;
D、Cu、Ag与稀盐酸不反应,无法比较二者的金属活动性大小,此试剂组不可行;
铜与硝酸银反应生成硝酸铜和银,反应的化学方程式为:Cu+2AgNO3═Cu(NO3)2+2Ag.
(2)由于金属的活动性是锌>铁>铜,铁粉加入盛有ZnSO4和CuSO4混合溶液的烧杯中,铁能与硫酸铜反应生成硫酸亚铁和铜,铁不能与硫酸锌反应,充分反应后过滤,在滤渣中滴入稀盐酸,有气泡产生.说明了铁有剩余,据此判断,滤渣中含有铜、铁;滤液中的溶质是 ZnSO4、FeSO4;滴加盐酸时铁与盐酸反应产生氯化亚铁和氢气,反应的方程式为:Fe+2HCl═FeCl2+H2↑.
故答为(1)D;Cu+2AgNO3═Cu(NO3)2+2Ag.(2)铜、铁; ZnSO4、FeSO4;Fe+2HCl═FeCl2+H2↑.
点评 要会利用金属活动顺序表设计实验,去验证金属的活动性强弱.氢前边的金属会与酸反应,但氢后边的金属不会与酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.但也要注意,与金属反应酸一般是指稀硫酸和盐酸,不包括浓硫酸和硝酸.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
| A. | ①和 ②② | B. | ②和 ③ | C. | ①和 ④ | D. | ①和 ⑤ |
| A. | 冰雪融化 | B. | 葡萄酿酒 | C. | 棉线织布 | D. | 黄瓜切成段 |
| A. | 蜡烛熔化 | B. | 饭菜变馊 | C. | 水的蒸发 | D. | 玻璃破碎 |
| A. | 用食盐水可以鉴别软水和硬水 | |
| B. | 电解水生成氢气和氧气,说明水是由氢气和氧气组成 | |
| C. | 活性炭具有吸附性,可用于除去水中的异味 | |
| D. | 保持水的化学性质的最小粒子是氢原子和氧原子 |
| A. | 用鸡蛋壳和白醋制取二氧化碳 | |
| B. | 用6B铅笔芯做导电性实验 | |
| C. | 用自来水清除水垢(主要成份是碳酸钙) | |
| D. | 用冷碟子放在蜡烛火焰上方制取炭黑 |
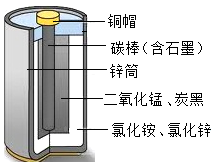 普通干电池在生活中的用途很广,其结构示意图如右图.回答下列问题:
普通干电池在生活中的用途很广,其结构示意图如右图.回答下列问题: