题目内容
4.根据下列装置图回答问题.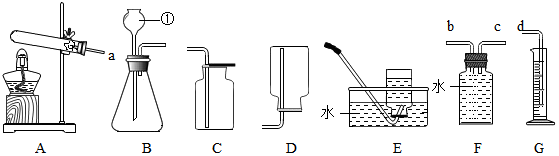
(1)标号仪器①的名称是长颈漏斗.
(2)实验室制取并收集二氧化碳,应选择的装置组合为B(填字母序号),反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.若要收集一氧化碳气体应选择的收集装置为E.(从C、D、E中选择)
(3)实验室用一定质量的高锰酸钾制取氧气,通过排水量测定所收集到的氧气体积(装置选用A、F、G). 若各装置的连接顺序是:a→b→c→d,F装置内导管(“b”或“c”)该怎样延伸?请画出.
(4)若用氯酸钾和二氧化锰来制取氧气,则二氧化锰在反应前后固体混合物中的质量分数将变大(填“变大”、“变小”或“不变”).
(5)高锰酸钾制取氧气应在试管口放一团棉花,试管中的棉花没有燃烧,根据燃烧的条件分析,主要原因是温度未达到着火点.
分析 (1)根据常用仪器的名称和用途判断;
(2)根据制取二氧化碳的反应物状态和反应的条件选择发生装置;根据二氧化碳的密度和溶解性选择收集装置;根据碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳书写化学方程式;根据一氧化碳的密度和空气接近,并且有毒,不溶于水进行分析;
(3)若各装置的连接顺序是:a→b→c→d,F装置内导管,c管延长,有利于排水;
(4)根据化学方程式:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑可知,二氧化锰在反应前后固体混合物中的质量分数的变化;
(5)根据燃烧的条件进行解答.
解答 解:(1)据图可以知道,①是试管,②是集气瓶,故填:试管,集气瓶;
(2)实验室制取二氧化碳使用的是碳酸钙固体和稀盐酸在常温下反应,故发生装置选择B;二氧化碳的密度比空气大,能溶于水,故选择C收集装置;碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;一氧化碳的密度和空气接近,并且有毒,不溶于水,不能用排气法收集,只能用排水法收集,故选择E收集装置;
(3)若各装置的连接顺序是:a→b→c→d,F装置内导管,c管延长,有利于排水,从而通过测量水的体积测量氧气的体积,故如图 ;
;
(4)根据化学方程式:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑可知,二氧化锰在反应前后固体混合物中的质量分数的变化为变大;
(5)燃烧的条件是可燃物、氧气、达到物质的着火点,前2项已具备,所以棉花未燃烧是因为未达到其着火点.
故答案为:(1)长颈漏斗;(2)BC;CaCO3+2HCl═CaCl2+H2O+CO2↑; E (3) ;(4)变大;(5)温度没有达到着火点.
;(4)变大;(5)温度没有达到着火点.
点评 本题考查了常见气体的实验室制取装置和收集方法,完成此题,可以依据已有的知识进行.解题时明确依据反应物的状态和条件选择发生装置,根据气体的密度和溶解性选择收集装置及方程式的书写.

| A. | 冰水混合物 | B. | 液态氧 | C. | 空气 | D. | 五氧化二磷 |
| A. | 呼出气体中的水蒸气含量大于空气中水蒸气含量 | |
| B. | 硫酸铜溶液和氢氧化钠溶液反应后,蓝色固体减少至消失,形成蓝色溶液 | |
| C. | 试管中的水沸腾时,看见试管口产生白雾 | |
| D. | 大理石和稀盐酸反应时,可以看到固体表面有二氧化碳气体冒出 |
