题目内容
14.某化学兴趣小组从某地采集到一块石灰石样品,想测定其主要成分CaCO3的质量分数,将其敲碎,取12.5g样品放入试管中,然后加入一定量的10%稀盐酸(杂质不与盐酸反应也不溶于水),恰好完全反应,收集到4.4g的气体.求:(1)样品中CaCO3的质量分数是多少?
(2)加入的稀盐酸的质量?
(3)恰好完全反应后所得溶液中溶质的质量分数时多少?
分析 本题可直接利用4.4g的气体即二氧化碳的质量,借助化学方程式来进行相关的计算.根据质量守恒来计算反应后溶液的质量.
解答 解:设样品中含碳酸钙的质量为x,盐酸溶液中含HCl的质量为y,生成氯化钙的质量为z
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73 111 44
x y z 4.4g
$\frac{100}{x}=\frac{73}{y}=\frac{111}{z}=\frac{44}{4.4g}$
x=10g;y=7.3g;z=11.1g
则(1)样品中CaCO3的质量分数为$\frac{10g}{12.5g}×100%$═80%;
(2)加入的稀盐酸的质量为:7.3g÷10%=73g;
(3)反应后所得溶液的质量为:10g+73g-4.4g=78.6g,反应后所得溶液溶质的质量分数为:$\frac{11.1g}{76.8g}×100%$=14.5%.
答:(1)样品中CaCO3的质量分数为80%;
(2)加入的稀盐酸的质量为73g;
(3)反应后所得溶液溶质的质量分数为14.5%.
点评 本题较简单,可直接利用化学方程式来计算,但应注意计算格式要规范,向规范要质量.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
4.下表列出了硝酸钾在不同温度下的溶解度.
(1)从上表你可以得到什么信息(写一条即可)?硝酸钾的溶解度随温度升高而增大
(2)某同学在20℃时进行了如下实验,得到相应的溶液①~⑤中,充分溶解形成不饱和溶液的是②③④.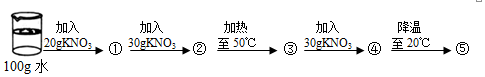
(3)20℃时,欲使一定量的硝酸钾饱和溶液变为不饱和溶液,可采取什么措施?增加溶剂(或升高温度)(任写一条)
| 温度(℃) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 溶解度(g) | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 |
(2)某同学在20℃时进行了如下实验,得到相应的溶液①~⑤中,充分溶解形成不饱和溶液的是②③④.

(3)20℃时,欲使一定量的硝酸钾饱和溶液变为不饱和溶液,可采取什么措施?增加溶剂(或升高温度)(任写一条)
9.某同学在实验室进行有关浓硫酸的实验,观察到瓶上的标签如下表所示,用于配制稀硫酸.求:欲配制1000克质量分数为19.6%的稀硫酸,
(1)需要多少克这种浓硫酸?
(2)需要加入多少毫升水?
| 浓硫酸(H2SO4)500毫升 | |
| 溶质的质量分数 | 98% |
| 密度 | 1.84克/厘米3 |
| 相对分子质量 | 98 |
| 强腐蚀性,阴冷,密封储藏 | |
(2)需要加入多少毫升水?
19.通过对已学知识的对比和归纳,可以得出一些十分有趣的规律.这些规律可以帮助我们掌握学习化学的方法.请你仔细阅读表中的内容,并回答相应的问题.
(1)由表格内容对照可得出的规律是:元素或原子团的化合价数值往往与相应离子所带的电荷数相等;
(2)硫酸亚铁受热能分解,产物均为氧化物,唯一的固体产物呈红色,结合表中信息和反应原理,写出该分解反应产物的化学式:Fe2O3、SO2、SO3;.
| 常见元素或原子团 | OH- | SO42- | CO32- | H元素 | Na元素 | Cl元素 | Fe元素 | S元素 |
| 常见化合价 | -1 | -2 | -2 | +1 | +1 | -1、+5、+7 | +2、+3 | -2、+4、+6 |
(2)硫酸亚铁受热能分解,产物均为氧化物,唯一的固体产物呈红色,结合表中信息和反应原理,写出该分解反应产物的化学式:Fe2O3、SO2、SO3;.
6.下列对有关溶液知识的解释不正确的是( )
| A. | 饱和溶液析出晶体后,溶质的质量分数可能不变 | |
| B. | “冬天捞碱,夏天晒盐”的主要原理是不同物质的溶解度随温度变化不同 | |
| C. | 不饱和溶液转化为饱和溶液,其溶质质量分数一定变大 | |
| D. | 向氯化铁溶液中加入少量生石灰,原溶液中溶质的溶解度和溶质质量分数都发生变化 |


 用某浓度的稀盐酸溶液50克和10%的氢氧化钠溶液进行反应时,反应过程中溶液的酸碱度变化如图所示:
用某浓度的稀盐酸溶液50克和10%的氢氧化钠溶液进行反应时,反应过程中溶液的酸碱度变化如图所示: