题目内容
18.下列关于水的性质叙述,不正确的是( )| A. | 纯净的水是没有颜色、没有气味、没有味道的液体 | |
| B. | 水的凝固是0℃,沸点是100℃ | |
| C. | 水在4℃时密度最大,为1克/厘米3 | |
| D. | 水通常较稳定,在高温或通电时才分解 |
分析 A.纯净的水是没有颜色、没有气味、没有味道的液体;
B、根据水的沸点、凝固点进行解答;
C、水在4℃时密度最大,为1克/厘米3;
D、水通常较稳定,在高温或通电时才分解.
解答 解:A.纯净的水是没有颜色、没有气味、没有味道的液体;说法正确;
B、在一标准大气压下,水的沸点是100℃、凝固点是0℃,故B错误;
C、水在4℃时密度最大,为1克/厘米3,正确;
D、水通常较稳定,在高温或通电时才分解,正确.
故选B.
点评 本题主要考查了物质的性质等方面的内容.完成此题,可以依据具体的描述做出判断.

练习册系列答案
相关题目
9.某同学在实验室进行有关浓硫酸的实验,观察瓶上的标签(如右表所示).他从瓶中倒出100毫升用于配制成稀硫酸,问
(1)这100毫升浓硫酸的质量为184克,其中含溶质硫酸180.32克.
(2)欲配制100毫升质量分数为20%的稀硫酸(密度为1.14克每立方厘米),需要多少毫升这种浓硫酸和多少毫升水?
| 浓硫酸(H2SO4)500毫升 | |
| 浓度(质量分数) | 98% |
| 密度 | 1.84克/厘米3 |
| 相对分子质量 | 98 |
| 强腐蚀性,阴冷,密封贮藏 | |
(2)欲配制100毫升质量分数为20%的稀硫酸(密度为1.14克每立方厘米),需要多少毫升这种浓硫酸和多少毫升水?
6.用如图所示装置(图中夹持仪器已略去)测定某牙膏样品中碳酸钙的质量分数.实验中,通过测定丙装置质量的改变值,就能达到目的(样品中其他成分遇盐酸不产生气体).下列措施能提高测定准确度的是( ) 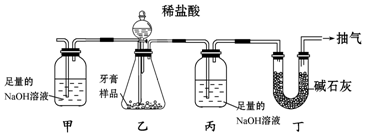

| A. | 省去装置甲和丁 | |
| B. | 将丙中的NaOH溶液换成Ca(OH)2溶液 | |
| C. | 滴加稀盐酸之前,先抽气一段时间,除去装置内原有的CO2 | |
| D. | 装置乙不再产生气泡时,立即停止抽气 |
10.金属Ni、Zn分别放入其他三种金属盐X、Y、Z的溶液中,置换反应的结果,有无金属析出的情况如下:
它们的金属活动性递减的顺序是X>Zn>Y>Ni>Z.
| X盐 | Y盐 | Z盐 | |
| Ni | 无 | 无 | 有 |
| Zn | 无 | 有 | 有 |
8.下列说法中正确的是( )
| A. | 在100g水里最多能溶解36g食盐,所以食盐的溶解度为36g | |
| B. | 所有固体物质的溶液度都随着温度的升高而增大 | |
| C. | 有过剩溶质存在于其中的溶液,一定是这种物质在该温度时的饱和溶液 | |
| D. | 20℃时100g水里溶解了30g硝酸钾,所以硝酸钾的溶质质量分数为30% |

