题目内容
18.某同学在厨房里看到的食用纯碱(主要成分是Na2CO3)包装袋信息:“净含量:500克,碳酸钠质量分数>98%”.为确定食用纯碱的纯度,他称取自带的食用纯碱5.5g放入烧杯中,再滴加盐酸至刚好完全反应,共用去溶质质量分数为7.3%的稀盐酸50g.(反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑)(1)配制50g溶质质量分数为7.3%的稀盐酸,需溶质质量分数为14.6%的盐酸,质量为25g,需用25mL的量筒量取水.(填“25mL”或“50mL”)
(2)通过计算判断该食用纯碱中碳酸钠的质量分数是否与包装袋信息相符.(计算结果精确到0.1%) (请在答题纸上写出完整的计算过程)
分析 (1)根据溶液稀释过程中溶质的质量保持不变计算,进而选择合适的量筒;
(2)根据计算确定碳酸钠的质量,进而求算混合物中碳酸钠的质量分数,对比标准确定.
解答 解:
(1)设需要的14.6%的盐酸的质量为x.
根据稀释前后溶质的质量不变可得
50g×7.3%=x×14.6%
x=25g
所以需要加入的水的质量为50g-25g=25g体积为25mL,所以需要25mL的量筒量取.
(2)设碳酸钠的质量为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73
y 50g×7.3%
$\frac{106}{73}$=$\frac{y}{50g×7.3%}$
x=5.3g
则样品中碳酸钠的质量分数为$\frac{5.3g}{5.5g}$×100%≈96.4%<98%.
含量与包装不符.
答:(1)配制50g溶质质量分数为7.3%的稀盐酸,需溶质质量分数为14.6%的盐酸,质量为 25g,需用 25mL的量筒量取水.
(2)通过计算判断该食用纯碱中碳酸钠的质量分数与包装袋信息不相符.
点评 溶液稀释中浓度降低一半,则加入的水的质量等于原溶液的质量.

练习册系列答案
相关题目
8.元素周期表是化学学习和研究的重要工具.表是元素周期表的一部分.
(1)从表中查出硫元素的相对原子质量为32.06;
(2)6-11号元素中属于金属元素的是Na(填元素符号);
(3)科学家宣布,现已人工合成了第120号元素,则此元素的核电荷数为120;
(4)与磷元素化学性质相似的元素是氮(填元素名称).
(5)请写出钾元素和硫元素形成的化合物的化学式K2S.
| 1 H 1.008 | 2 He 4.003 | |||||||
| 3 Li 6.941 | 4 Be 9.012 | … | 5 B 10.81 | 6 C 12.01 | 7 N 14.01 | 8 O 16.00 | 9 F 19.00 | 10 Ne 20.18 |
| 11 Na 22.99 | 12 Mg 24.31 | 13 Al 26.98 | 14 Si 28.09 | 15 P 30.97 | 16 S 32.06 | 17 Cl 35.45 | 18 Ar 39.95 | |
(2)6-11号元素中属于金属元素的是Na(填元素符号);
(3)科学家宣布,现已人工合成了第120号元素,则此元素的核电荷数为120;
(4)与磷元素化学性质相似的元素是氮(填元素名称).
(5)请写出钾元素和硫元素形成的化合物的化学式K2S.
9.下列实验目的对应的实验方法正确的是( )
| 实验目的 | 实验方法 | |
| A | 除去FeCl2溶液中的CuCl2 | 加入过量锌粉,充分反应后过滤 |
| B | 除去CO2 中的少量 CO | 向混合气体中鼓入过量氧气点燃 |
| C | 鉴别氢气、一氧化碳和甲烷 | 通过澄清的石灰水 |
| D | 除去氧化铜中的碳粉 | 在空气中灼烧 |
| A. | A | B. | B | C. | C | D. | D |
3.要取用4至5mL 蒸馏水进行加热,有以下加热步骤,正确的顺序是( )
①点燃酒精灯;②加热;③用试管夹夹好试管;④往试管里加入蒸馏水;⑤把试剂瓶盖好放回原处.
①点燃酒精灯;②加热;③用试管夹夹好试管;④往试管里加入蒸馏水;⑤把试剂瓶盖好放回原处.
| A. | ①④③②⑤ | B. | ①③④②⑤ | C. | ④⑤③①② | D. | ④③⑤①② |
10.欲除去CO2中混有的少量CO气体,可采用的方法是( )
| A. | 将混合气体点燃 | |
| B. | 将混合气体通过澄清石灰水 | |
| C. | 将混合气体通过足量灼热的氧化铜粉末中 | |
| D. | 将混合气体通过足量灼热的碳粉中 |
7.如图所示:甲瓶中盛放的是浓H2SO4(有吸水性),乙瓶中放的是用石蕊溶液染成紫色的干燥小花,若关闭阀门Ⅰ,打开阀门Ⅱ,紫色小花a色;若关闭阀门Ⅱ,打开阀门Ⅰ,紫色小花b色,a、b依次为( )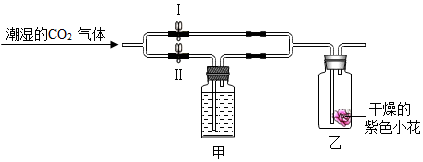

| A. | 红色、红色 | B. | 蓝色、紫色 | C. | 红色、紫色 | D. | 紫色、红色 |