题目内容
10.A常用于切割金属,在点燃条件下,A和B反应能生成C和D,反应前后各粒子变化的微观示意图如图所示.
(1)上述物质中由分子构成的是ABD(填字母序号)
(2)上述反应的化学方程式为2C2H2+O2$\frac{\underline{\;点燃\;}}{\;}$4C+2H2O;此过程中发生改变的粒子是分子.
分析 根据变化的微观示意图,分析物质的微观构成、物质的名称,再找出物质之间的微粒数目关系,写出反应的方程式,然后再对题中各问加以分析解答.
解答 解:由反应的微观示意图可以得出各物质反应的微粒关系如下:A为C2H2;B为O2;C为C,D为H2O;
发生反应的化学方程式为:2C2H2+O2$\frac{\underline{\;点燃\;}}{\;}$4C+2H2O;
(1)由图示可知上述物质中由分子构成的是ABD;
(2)反应的化学方程式为:2C2H2+O2$\frac{\underline{\;点燃\;}}{\;}$4C+2H2O;此过程中发生改变的粒子是分子;
答案:(1)ABD;
(2)2C2H2+O2$\frac{\underline{\;点燃\;}}{\;}$4C+2H2O;分子.
点评 本题综合性较强,涉及的知识点较多,因此要从概念的科学定义出发,逐一解答.对于方程式书写的解答要注意配平,不能光看图示,否则容易出错.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.灼烧氯化钠时火焰的颜色呈( )
| A. | 紫色 | B. | 蓝色 | C. | 黄色 | D. | 绿色 |
1.“用双氧水和二氧化锰制氧气”的反应方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.某同学做了该实验后,展开了下列思考与探究:
(1)催化剂MnO2的用量对反应速率有没有影响呢?他做了这样一组实验:每次均用30mL10%的H202溶液,采用不同量MnO2粉末做催化剂,测定各次收集到500mL氧气时所用的时间,结果如下:(其他实验条件均相同)
请分析表中数据回答:MnO2的用量对反应速率的影响有影响,在一定范围内,MnO2的用量越大,反应越快.
(2)H2O2溶液的溶质质量分数对反应速率有没有影响呢?
他又做了一组实验:每次均取5mL30%的H2O2溶液,然后稀释成不同溶质质量分数的溶液进行实验.记录数据如下:(实验均在20℃室温下进行,其他实验条件也均相同)
请分析表中数据回答:H2O2溶液的溶质质量分数对反应速率的影响有影响,其他条件相同时,H2O2溶液的溶质质量分数越大,反应越快.
(3)还有哪些因素可能影响该反应的速率呢?请说出你的一个猜想:MnO2颗粒大小.
(4)为了让我们的实验结论有说服力,在做对比实验时,对于实验条件的把控,我们一定要注意的原则问题是每次只改变一个实验条件,这种科学研究的方法我们称之为“控制变量法”.
(1)催化剂MnO2的用量对反应速率有没有影响呢?他做了这样一组实验:每次均用30mL10%的H202溶液,采用不同量MnO2粉末做催化剂,测定各次收集到500mL氧气时所用的时间,结果如下:(其他实验条件均相同)
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| MnO2粉末用量(克) | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 | 1.0 |
| 所用时间(秒) | 17 | 8 | 7 | 5 | 4 | 3 | 2 | 2 | 2 | 2 |
(2)H2O2溶液的溶质质量分数对反应速率有没有影响呢?
他又做了一组实验:每次均取5mL30%的H2O2溶液,然后稀释成不同溶质质量分数的溶液进行实验.记录数据如下:(实验均在20℃室温下进行,其他实验条件也均相同)
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| H2O2溶液溶质质量分数 | 1% | 3% | 5% | 10% | 15% | 20% | 25% | 30% |
| MnO2粉末用量/克 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 |
| 收集到540mL气体时所用时间/秒 | 660 | 220 | 205 | 80 | 25 | 9 | 4 | 3 |
| 反应后液体温度/℃ | 24 | 34 | 39 | 56 | 65 | 67 | 69 | 70 |
(3)还有哪些因素可能影响该反应的速率呢?请说出你的一个猜想:MnO2颗粒大小.
(4)为了让我们的实验结论有说服力,在做对比实验时,对于实验条件的把控,我们一定要注意的原则问题是每次只改变一个实验条件,这种科学研究的方法我们称之为“控制变量法”.
18.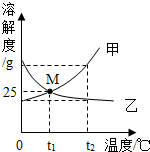 如图为甲、乙两物质(均不含结晶水)的溶解度曲线,下列说法错误的是( )
如图为甲、乙两物质(均不含结晶水)的溶解度曲线,下列说法错误的是( )
 如图为甲、乙两物质(均不含结晶水)的溶解度曲线,下列说法错误的是( )
如图为甲、乙两物质(均不含结晶水)的溶解度曲线,下列说法错误的是( )| A. | 乙的饱和溶液由t2℃降温到t1℃时,溶质的质量分数不变 | |
| B. | 除去甲中含有的少量乙,可以用冷却热饱和溶液的方法 | |
| C. | t1℃时,50g水中分别加入25g的甲、乙,均可得到75g的饱和溶液 | |
| D. | t1℃时,等质量甲、乙两物质的饱和溶液蒸发等质量的水,所得溶液中溶质的质量一定相等 |
15.每年的6月5日是世界环境日,建立世界环境日的目的是:倡导人们在日常生活中节约能源,减少二氧化碳的排放.下列做法不符合该目的是( )
| A. | 购物时用布袋代替塑料袋 | B. | 外出尽量步行或骑自行车 | ||
| C. | 充分利用太阳能 | D. | 直接燃烧煤炭 |
2.小王同学对所学部分化学知识归纳如下,其中有错误的一组是( )
| A.物质区别 | B.灭火方法 |
| 区分食盐水和蛋白质溶液--用饱和 (NH4)2SO4溶液 | 电器着火--切断电源,用液态二氧化碳灭火器灭火 |
| C.实验记录 | D.生活常识 |
| 用10ml量筒量取7.25mL水 | 用洗涤剂洗油污--乳化作用 |
| A. | 物质区别 | B. | 灭火方法 | C. | 实验记录 | D. | 生活常识 |
 在农业生产中,农作物一般适宜在pH=7或接近7的土壤中生长,月月同学发现自家的盆栽君子兰长势不好,她怀疑土壤呈酸性,她准备用pH试纸测定花盆中花土的pH,请你同月月同学一同测定,验证她的猜想正确,并提出解决的办法.
在农业生产中,农作物一般适宜在pH=7或接近7的土壤中生长,月月同学发现自家的盆栽君子兰长势不好,她怀疑土壤呈酸性,她准备用pH试纸测定花盆中花土的pH,请你同月月同学一同测定,验证她的猜想正确,并提出解决的办法. 厉山中心学校的聪聪同学为了比较铁、铜和未知金属X的活动性大小,设计了如图所示实验.
厉山中心学校的聪聪同学为了比较铁、铜和未知金属X的活动性大小,设计了如图所示实验.