题目内容
初中化学教材中的一些实验如下图,请你回答下列问题:
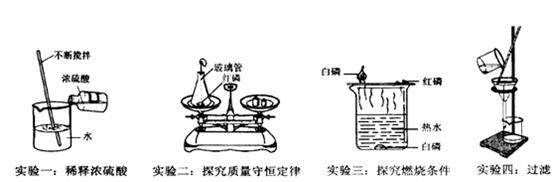 (1)实验一玻璃棒不断搅拌的目的是__________________________;
(1)实验一玻璃棒不断搅拌的目的是__________________________;
(2)实验二锥形瓶内产生的主要现象是___________________________;
(3)由实验三除了能得出可燃物燃烧的条件外,还可以比较出白磷、红磷化学性质上的不同点是___________________________________________。
(4)实验四得到的滤液仍然浑浊,原因是___________________________(答一点即可)。
【答案】(1)散热 (2)产生大量白烟(答产生大量白烟、放热也可) (3)红磷的着火点比白磷高,着火点不同,白磷的着火点比红磷低 (4)履职破损,液面高于滤纸边缘,仪器不干净
【解析】(1)浓硫酸溶于水时放出热量,搅拌的目的是使放出的热量散失;(2)锥形瓶内发生的反应为红磷燃烧, 红磷燃烧的现象为放出大量白烟;(3)根据铜片上的白磷燃烧而红磷不燃烧可知,白磷的着火点比红磷低;(4)过滤后滤液仍然浑浊,原因可能是滤纸破损、液面高于滤纸边缘、仪器不干净、倾倒待过滤液体时液体洒出落 入烧杯等。
入烧杯等。

 全能闯关100分系列答案
全能闯关100分系列答案厨房中有一包无标识的白色粉末,经初步认定可能是氯化钠、碳酸钠、碳酸氢钠中的一种。小明对白色粉末的成分进行了探究。
[查阅资料]碳酸钠俗称 ▲ 、苏打,碳酸氢钠俗称小苏打,两者都属于 ▲ (选填“酸”、“碱”、“盐”),都能溶于水,且水溶液都呈碱性。
[实验探究]小明取适量白色粉末,配制成溶液,按表中所示实验方案进行探究。
| 实验步骤 | 实验内容 | 实验现象 | 实验结论 |
| 1 | 取少量溶液,滴加无色酚酞溶液 | 溶液变红色 | 白色粉末肯定不是 ▲ |
| 2 | 取少量溶液,滴加稀盐酸 | ▲ | |
| 3 | 取少量溶液,滴加澄清石灰水 | 产生白色沉淀 |
(1)请完成表中空格。
(2)实验步骤2中可能发生反应的化学方程式为 ▲ (写出一个即可)。实验步骤
3中白色沉淀的成分是 ▲ (填写化学式)。
[实验反思]小明实验后发现上述实验方案并不能确定白色粉末的组成。经老师指导后,小明再取少量配制的溶液滴加氯化钙溶液,没有观察到明显现象,则该白色粉末是 ▲ 。
的白色粉末,请你和同学们一起参与探究该白色粉末的主要成分。
(1)提出问题:该白色粉末的主要成分是什么?
(2)查阅资料
| 化学式 | 酸碱性 | 与稀盐酸作用 | 毒性 |
| NaNO2 | 碱性 | 放出棕红色气体 | 有 |
| NaCl | 中性 | 不反应 | 无 |
(3)提出猜想:
猜想I:只含有NaCl、Na2S04 猜想Il:只含有NaCl、NaNO2
猜想III:只含有 猜想IV:含有NaCl、Na2S04、NaNO2
(4)进行探究
| 步骤 | 实验操作 | 实验现象 | 结论 |
| 步骤一 | 取少量固体样品于两支试管中,加蒸馏水溶解,向试管1滴人无色酚酞溶液,向试管2滴人过量的氯化钡溶液。 | 试管1:溶液变红色 试管2:无明显现象. | 一定有 一定没有 |
| 、步骤二 | 另取适量固体样品于试管中,加蒸馏水溶解,滴加硝酸银溶液 | 有白色沉淀产生。 | 一定有 |
(5)通过实验.猜想 成立。
(6)写出步骤二中发生的化学方程式 。
(7)拓展:粗盐中常含有可溶性和不溶性杂质,粗盐提纯的基本操作步骤是溶解、 、蒸发。
酸雨往往含有硫酸、盐酸和硝酸等三种成分,但地区不同,成分也不同,要治理酸雨,先要确定其组成,兴趣小组对当地的酸雨进行探究,请你参与探究过程:
(1)若要确定该地区酸雨的pH,最简便的方法是使用____________________;
(2)设计实验方案,探究该地区酸雨是否存在硫酸和盐酸,填写下来。(已知硫酸银微溶于水)
限选试剂:NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、AgNO3溶液
| 实验步骤 | 预期现象与结论 |
| 步骤1:取适量的溶液于试管中,_______________________ | __________________________________ |
| 步骤2:取适量步骤1中的上层清液与试管中,_____________________________________________________________ | __________________________________ |
 的产物进行探究。
的产物进行探究。
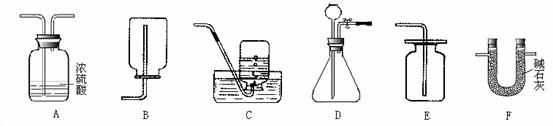
 4)甲烷是一种密度比空气小、难溶于水的气体。实验室常用无水醋酸钠固体和碱石灰固体共热制取甲烷,应该选择的发生装置是
4)甲烷是一种密度比空气小、难溶于水的气体。实验室常用无水醋酸钠固体和碱石灰固体共热制取甲烷,应该选择的发生装置是 