题目内容
9.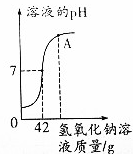 烧杯中有100g溶质的质量分数为9.8%的稀硫酸,向烧杯中逐渐加入氢氧化钠溶液,烧杯内溶液的pH与加入氢氧化钠溶液质量的变化关系如图所示.
烧杯中有100g溶质的质量分数为9.8%的稀硫酸,向烧杯中逐渐加入氢氧化钠溶液,烧杯内溶液的pH与加入氢氧化钠溶液质量的变化关系如图所示.请回答下列问题
(1)A点处溶液中的溶质是氢氧化钠、硫酸钠.
(2)请计算恰好完全反应时所得溶液中溶质的质量分数.
分析 (1)根据图象中在A点时溶液的pH大于7进行分析解答.
(2)根据硫酸的质量求出生成的硫钠的质量,再根据溶质的质量分数计算即可.
解答 解:(1)由于向硫酸溶液中加入氢氧化钠时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O,由图象可知,在A点时溶液的pH大于7,溶液显碱性,氢氧化钠有剩余,溶液中的溶质是剩余的氢氧化钠溶液中的氢氧化钠和反应生成的硫酸钠;
(2)恰好完全反应时反应的硫酸的质量为:100g×9.8%=9.8g
设生成硫酸钠的质量为x
H2SO4+2NaOH=Na2SO4+2H2O
98 142
9.8g x
$\frac{98}{142}=\frac{9.8g}{x}$ 解得:x=1.42g
恰好完全反应时所得溶液中溶质的质量分数是:$\frac{1.42g}{100g+42g}×100%$=1%.
故答为:(1)氢氧化钠、硫酸钠.(2)恰好完全反应时所得溶液中溶质的质量分数时1%.
点评 本题难度不大,主要考查了中和反应及其应用,掌握溶液的酸碱性和溶液pH大小之间的关系、从数形结合的角度理解中和反应是正确解答本题的关键.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
19.下列物质属于纯净物的是( )
| A. | 空气 | B. | 液态氮 | C. | 可乐 | D. | 自来水 |
4.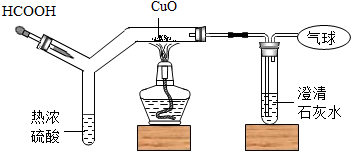 如图为CO还原CuO“微型”实验装置(夹持仪器已略去),已知:HCOOH$\frac{\underline{\;热浓硫酸\;}}{\;}$H2O+CO↑,下列说法错误的是( )
如图为CO还原CuO“微型”实验装置(夹持仪器已略去),已知:HCOOH$\frac{\underline{\;热浓硫酸\;}}{\;}$H2O+CO↑,下列说法错误的是( )
 如图为CO还原CuO“微型”实验装置(夹持仪器已略去),已知:HCOOH$\frac{\underline{\;热浓硫酸\;}}{\;}$H2O+CO↑,下列说法错误的是( )
如图为CO还原CuO“微型”实验装置(夹持仪器已略去),已知:HCOOH$\frac{\underline{\;热浓硫酸\;}}{\;}$H2O+CO↑,下列说法错误的是( )| A. | 实验中所需CO可现制现用 | |
| B. | 此装置可节约药品,污染小,现象明显 | |
| C. | 此装置内空间较小,空气易排尽,实验危险系数小 | |
| D. | 该实验中CO是还原剂,发生了还原反应 |
14.现有锌和另一种金属组成的混合物,把6.5g该混合物加入到100g一定溶质质量分数的稀硫酸中,恰好完全反应,产生氢气的质量为w.则下列说法中正确的是( )
| A. | 若混合物为Zn、Al,w可能是0.2g | |
| B. | 若混合物为Zn、Fe,w不可能是0.2g | |
| C. | 若混合物为Zn、Cu,w是0.2g,则该混合物中锌的质量分数为50% | |
| D. | 若混合物为Zn、Mg,则加入的稀硫酸中溶质质量分数一定大于10% |
2.下列说法正确的是( )
①原子是保持物质化学性质的最小微粒;②合金的硬度比成分中的纯金属的硬度更大,而熔点更低;
③由一种元素组成的物质可能是混合物;④生铁、不锈钢、金刚石都属于合金.
①原子是保持物质化学性质的最小微粒;②合金的硬度比成分中的纯金属的硬度更大,而熔点更低;
③由一种元素组成的物质可能是混合物;④生铁、不锈钢、金刚石都属于合金.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
20.用高锰酸钾(KMnO4)、氯酸钾(KClO3)、过氧化氢(H2O2)三种物质都可制得氧气,说明它们的组成中都含有( )
| A. | 氧分子 | B. | 氧元素 | C. | 氧化物 | D. | 氧原子 |
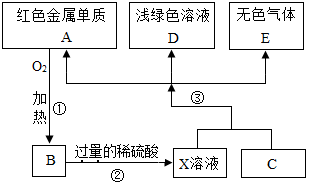 A、B、C、D、E为初中化学常见的物质,其中A、C为金属单质,E为非金属单质,如图是它们之间的相互转化关系.请回答:
A、B、C、D、E为初中化学常见的物质,其中A、C为金属单质,E为非金属单质,如图是它们之间的相互转化关系.请回答: