题目内容
10.所给粒子结构示意图如下图,下列说法正确的是( )
| A. | 它们都是离子 | B. | 它们都是原子 | ||
| C. | 它们都是相对稳定的 | D. | 甲与丙能构成离子化合物 |
分析 根据元素的定义及原子和离子的核内质子数与核外电子数的关系分析. 当核电荷数=质子数=核外电子数,为原子;当核电荷数=质子数>核外电子数,为阳离子;当核电荷数=质子数<核外电子数,为阴离子;相对稳定结构是指最外层电子数为8,只有一个电子层时为2的结构.
解答 解:A、丙中质子数11大于核外电子数10,是阳离子,甲中质子数8小于核外电子数10,属于阴离子,乙和丁中质子数等于核外电子数,是原子,故A错误;
B、丙中质子数11大于核外电子数10,是阳离子,甲中质子数8小于核外电子数10,属于阴离子,B错误;
C、丁中最外层电子层为7,大于4个易得到电子,不是稳定结构,其它三种粒子最外层电子数为8,达到8电子的相对稳定结构,故C错误;
D、甲是氧离子,丙是钠离子,甲与丙能构成离子化合物,故D正确.
故选D
点评 本题考查学生对粒子结构示意图及其意义的理解,明确粒子中核内质子数和核外电子数之间的关系、核外电子在化学变化中的作用和得失电子的规律特点等是解题的关键.

练习册系列答案
相关题目
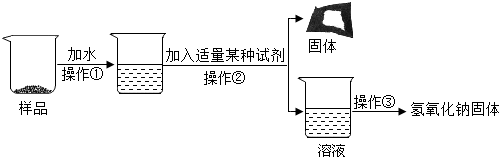
20.氢氧化钠是一种重要的化工原料,也是实验室中常见的一种试剂,氢氧化钠必须密封保存,用化学方程式表示变质原因2NaOH+CO2═Na2CO3+H2O.
探究一:确定一瓶氢氧化钠固体是否变质
探究二:确定氢氧化钠固体变质的程度
实验方案中滴入过量的CaCl2溶液目的是除尽碳酸钠.
探究一:确定一瓶氢氧化钠固体是否变质
| 实验操作 | 实验现象 | 结论 |
| 取少量样品于试管中,加入适量水,样品全溶解后,滴加足量的稀盐酸(填一种溶液名称) | 有气泡产生 | 氢氧化钠固体已变质 |
| 实验操作 | 实验现象 | 结论 |
| ①取少量样品于试管中,加入适量水,样品全溶解后,滴加过量的CaCl2溶液 | 产生白色沉淀 | 氢氧化钠固体部分变质 |
| ②静置后取上层清液于试管中,滴入2滴酚酞试液 | 溶液变为红色 |
1.推理是学习化学的一种重要方法,下列推理不正确的是( )
| A. | 甲烷、液化气等有机物都具有可燃性,则CO也具有可燃性 | |
| B. | Mg、Al等金属都能在空气中燃烧,则Cu也能在空气中燃烧 | |
| C. | NaOH溶液、石灰水等碱溶液都使酚酞试液变红,则KOH溶液也能使酚酞试液变红 | |
| D. | H2、乙炔与一定量空气混合遇明火可能会爆炸,则CH4与空气混合遇明火也可能爆炸 |
18. 某学习小组探究氢氧化钙溶液的化学性质,并作了延伸探究.
某学习小组探究氢氧化钙溶液的化学性质,并作了延伸探究.
探究一:甲同学设计了如下实验方案,请你帮助完成实验报告.
探究一:甲同学设计了如下实验方案,请你帮助完成实验报告.
【提出问题】实验方案(3)褪色后溶液中的溶质是什么?
【查阅资料】氯化钙溶液呈中性.
【作出猜想】乙同学从反应情况分析,溶液中除含少量酚酞外,溶质可能有以下三种情况:
①氯化钙;②氯化钙和氯化氢;③氯化钙和氢氧化钙
【分析讨论】丙同学从实验现象分析得出:猜想③肯定不合理,其理由是稀盐酸加入滴有酚酞的石灰水中,红色褪为无色,说明溶液为中性或酸性,不可能有氢氧化钙,故猜想③肯定不合理;.
探究二:丁同学为进一步验证乙同学的猜想,设计实验如下:将实验方案(3)褪色后溶液倒入烧杯中,向其中逐滴滴加稀碳酸钠溶液至过量,边滴边振荡.实验后得出产生沉淀质量与滴加碳酸钠溶液体积之间的关系,如图所示.写出实验过程中的现象滴加碳酸钠溶液,开始先产生气泡,随后才产生沉淀,溶液最终变红色.
【得出结论】乙同学的猜想中,②(填序号)合理.
【反思讨论】学习小组结合图象,分析了丁同学实验过程中烧杯内溶液的变化.下列说法正确的是AB.(填序号)
A.溶液质量逐渐增大 B.氯化钠质量逐渐增大,V2后不变
C.氯化钙的质量先增大后减小 D.溶液的pH一直在增大.
 某学习小组探究氢氧化钙溶液的化学性质,并作了延伸探究.
某学习小组探究氢氧化钙溶液的化学性质,并作了延伸探究.探究一:甲同学设计了如下实验方案,请你帮助完成实验报告.
探究一:甲同学设计了如下实验方案,请你帮助完成实验报告.
| 方案 | (1) | (2) | (3) |
| 实验操作 |  |  |  |
| 现象 | 溶液变为蓝色 | 澄清石灰水变浑浊 | 红色褪为无色 |
| 结论或解释 | 氢氧化钙溶液能使石蕊等酸碱指示剂变色 | 氢氧化钙溶液能与某些非金属氧化物反应生成盐和水.二氧化硫与澄清石灰水反应的化学方程式是 SO2+Ca(OH)2═CaSO3↓+H2O | 氢氧化钙溶液能与酸发生中和反应 |
【查阅资料】氯化钙溶液呈中性.
【作出猜想】乙同学从反应情况分析,溶液中除含少量酚酞外,溶质可能有以下三种情况:
①氯化钙;②氯化钙和氯化氢;③氯化钙和氢氧化钙
【分析讨论】丙同学从实验现象分析得出:猜想③肯定不合理,其理由是稀盐酸加入滴有酚酞的石灰水中,红色褪为无色,说明溶液为中性或酸性,不可能有氢氧化钙,故猜想③肯定不合理;.
探究二:丁同学为进一步验证乙同学的猜想,设计实验如下:将实验方案(3)褪色后溶液倒入烧杯中,向其中逐滴滴加稀碳酸钠溶液至过量,边滴边振荡.实验后得出产生沉淀质量与滴加碳酸钠溶液体积之间的关系,如图所示.写出实验过程中的现象滴加碳酸钠溶液,开始先产生气泡,随后才产生沉淀,溶液最终变红色.
【得出结论】乙同学的猜想中,②(填序号)合理.
【反思讨论】学习小组结合图象,分析了丁同学实验过程中烧杯内溶液的变化.下列说法正确的是AB.(填序号)
A.溶液质量逐渐增大 B.氯化钠质量逐渐增大,V2后不变
C.氯化钙的质量先增大后减小 D.溶液的pH一直在增大.
5.有一根部分氧化的镁条4.4g(只含氧化镁一种杂质),与100g质量分数为14.7%的稀硫酸恰好完全反应,将反应后溶液蒸发得到硫酸镁的质量为18g,则原镁条中含氧元素的质量为( )
| A. | 0.8g | B. | 1.2g | C. | 2.4g | D. | 3.6g |
15.下列各组物质的溶液,不另加试剂则无法鉴别的是( )
| A. | NaOH、HCl、CuSO4、MgSO4 | B. | KNO3、HCl、NaCl、NaOH | ||
| C. | Na2CO3、K2SO4、BaCl2、HCl | D. | 酚酞、H2SO4、NaOH、MgCl2 |

 在实验室里用浓度为98%的浓硫酸和蒸馏水配制稀硫酸.
在实验室里用浓度为98%的浓硫酸和蒸馏水配制稀硫酸.