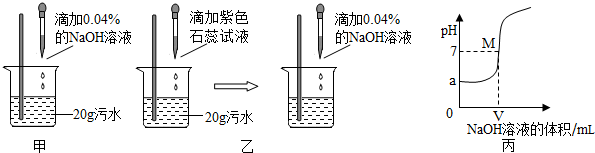
题目内容
13.在点燃的条件下,A和B反应生成C和D,反应前后分子变化的微观示意图如下.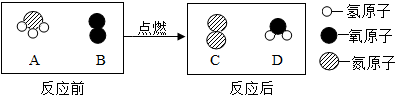
(1)四种物质中属于氧化物的是D(填字母);
(2)保持B物质化学性质的最小粒子名称是氧分子;
(3)在该化学变化过程中,不可再分的粒子有3种(填数字);
(4)该反应的基本反应类型是置换反应.
分析 利用反应前后分子变化的微观示意图可知,该反应的反应物A的分子由1个N原子和3个H原子构成的NH3分子,反应物B的分子由2个O原子构成的O2分子;生成物C的分子由2个N原子构成的N2分子,生成物D的分子由1个O原子和2个H原子构成的H2O分子;则反应的化学方程式为4NH3+3O2 $\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O,据此完成相关的问题.
解答 解:(1)该反应的反应物NH3和O2、生成物N2和H2O中,属于氧化物的是H2O,故填:D;
(2)B是氧气,保持氧气化学性质的微粒是氧分子;故填:氧分子;
(3)化学反应前后不可再分的微粒是原子,共有N、H、O三种原子;故填:3;
(4)该反应的方程式为:4NH3+3O2 $\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O,是单质和化合物反应产生新的单质和新的化合物,因此属于置换反应;故填:置换反应.
点评 本题属于微观示意图的考查,解答本题的关键由分子微观示意图确定分子构成,利用分子构成写出物质的化学式及化学方程式,能够考查知识运用能力.

练习册系列答案
相关题目
3.镁原子的结构示意图如图所示,对镁原子的说法错误的是( )
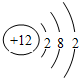

| A. | 核电荷数为12 | |
| B. | 该元素在元素周期表中处在第三周期 | |
| C. | 带12个单位正电荷 | |
| D. | 在化学反应中,易失去最外层的2个电子 |
8.下列归纳总结中,正确的是( )
| A. | CO2、SO2、H2O2三种物质中,都含有氧气 | |
| B. | Na、Na+具有相同的质子数,都属于同种元素 | |
| C. | NaOH、Ca(OH)2都是常见的碱,都可用于改良酸性土壤 | |
| D. | 不用任何试剂,都能用闻气味的方法检验某盐中是否含有NH4+ |
5.下列有关实验操作的说法中,错误的是( )
| A. | 做氢气燃烧的实验前要先检验纯度再点燃 | |
| B. | 做一氧化碳还原氧化铜实验时要先通一段时间一氧化碳再加热 | |
| C. | 用PH试纸测溶液的酸碱度时,要先将试纸润湿再滴待测液 | |
| D. | 稀释浓硫酸时要先在烧杯中加水,再加浓硫酸并用玻璃棒不断搅拌 |
2.下列有关生活中化学知识的说法,正确的是( )
| A. | 纯棉床单、塑料包装袋、电木插座等都属于有机合成材料 | |
| B. | 糖类和油脂在人体内转化后能为机体供能 | |
| C. | 钙、铁、铅都是人体必需的微量元素 | |
| D. | 生活中常用甲醛浸泡水产品,达到保鲜的目的 |
3.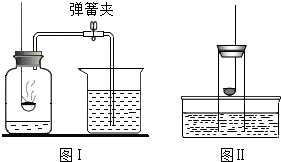 下列关于测定空气中氧气含量的实验分析中(图中药品为红磷和水),不正确的是( )
下列关于测定空气中氧气含量的实验分析中(图中药品为红磷和水),不正确的是( )
 下列关于测定空气中氧气含量的实验分析中(图中药品为红磷和水),不正确的是( )
下列关于测定空气中氧气含量的实验分析中(图中药品为红磷和水),不正确的是( )| A. | 不能用木炭代替红磷 | |
| B. | 图II所示装置也可以测定空气中氧气含量 | |
| C. | 图I中进入集气瓶的水约占烧杯中水的五分之一 | |
| D. | 氮气不与红磷反应且难溶于水,是设计该实验的依据之一 |