题目内容
 碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容.
碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容.(1)如图为元素周期表中的一格,下列说法不正确的是
A.碳元素属于非金属元素 B.碳原子核内质子数为6
C.碳元素的结构示意图为
 D.碳的相对原子质量为12.01
D.碳的相对原子质量为12.01(2)写出碳的一种氧化物的化学式及碳的化合价分别是
(3)完成下列化学方程式:

①
(4)称取12.5g生石灰(主要成分是CaCO3,杂质不参加反应)放入烧杯中,向其中加入50g稀盐酸,二者恰好完全反应.反应结束后称量烧杯中剩余物质的总质量为58.1g(不包括烧杯的质量,且气体的溶解发忽略不计).试计算石灰石中杂质的质量分数.
考点:元素周期表的特点及其应用,物质的相互转化和制备,化学式的书写及意义,有关元素化合价的计算,根据化学反应方程式的计算
专题:碳单质与含碳化合物的性质与用途
分析:(1)根据元素周期表中的一个小格中的信息可知元素的名称、元素符号、质子数、相对原子质量等来解答即可.
(2)碳的化合物主要有两种;
(3)根据反应物、生成物和条件书写化学方程式;
(4)根据药品质量的减少量是生成二氧化碳的质量,再根据二氧化碳的质量算出碳酸钙的质量,再用混合物质量减去碳酸钙的质量就是杂质质量.
(2)碳的化合物主要有两种;
(3)根据反应物、生成物和条件书写化学方程式;
(4)根据药品质量的减少量是生成二氧化碳的质量,再根据二氧化碳的质量算出碳酸钙的质量,再用混合物质量减去碳酸钙的质量就是杂质质量.
解答:解:(1)A、因碳的偏旁为“石”,则碳元素为非金属元素,故A说法正确;
B、由信息可知,碳原子的质子数为6,故B说法正确;
C、碳原子的质子数为6,则原子结构中最外层电子数应为4,故C错误;
D、由信息可知,碳原子的相对原子质量为12.01,故D说法正确;
故选C.
(2)碳的化合物主要有两种,二氧化碳中碳的化合价为+4价;一氧化碳中碳的化合价为+2价;
(3)①碳完全燃烧生成二氧化碳,方程式为:C+O2
CO2
②碳不完全燃烧生成二氧化碳,方程式为:2C+O2
2CO
③一氧化碳燃烧生成二氧化碳,反应的化学方程式为:2CO+O2
2CO2.
④二氧化碳通过炽热碳层生成一氧化碳,反应的化学方程式为:CO2+C
2CO.
(4)根据药品质量的减少量是生成二氧化碳的质量,所以生成二氧化碳:12.5g+50g-58.1g=4.4g,设要生成4.4g二氧化碳需碳酸钙质量为X则:
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
X 4.4g
根据:
=
解得X=10g,所以含杂质12.5g-10g=2.5g,所以杂质质量分数:
×100%=25%.
故答案为:(1)C;(2)CO2;+4(或CO;+2)
(3)①C+O2
CO2
②2C+O2
2CO
③2CO+O2
2CO2.
④CO2+C
2CO.
(4)25%.
B、由信息可知,碳原子的质子数为6,故B说法正确;
C、碳原子的质子数为6,则原子结构中最外层电子数应为4,故C错误;
D、由信息可知,碳原子的相对原子质量为12.01,故D说法正确;
故选C.
(2)碳的化合物主要有两种,二氧化碳中碳的化合价为+4价;一氧化碳中碳的化合价为+2价;
(3)①碳完全燃烧生成二氧化碳,方程式为:C+O2
| ||
②碳不完全燃烧生成二氧化碳,方程式为:2C+O2
| ||
③一氧化碳燃烧生成二氧化碳,反应的化学方程式为:2CO+O2
| ||
④二氧化碳通过炽热碳层生成一氧化碳,反应的化学方程式为:CO2+C
| ||
(4)根据药品质量的减少量是生成二氧化碳的质量,所以生成二氧化碳:12.5g+50g-58.1g=4.4g,设要生成4.4g二氧化碳需碳酸钙质量为X则:
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
X 4.4g
根据:
| 100 |
| X |
| 44 |
| 4.4g |
解得X=10g,所以含杂质12.5g-10g=2.5g,所以杂质质量分数:
| 2.5g |
| 10g |
故答案为:(1)C;(2)CO2;+4(或CO;+2)
(3)①C+O2
| ||
②2C+O2
| ||
③2CO+O2
| ||
④CO2+C
| ||
(4)25%.
点评:此题综合考查了碳及碳的化合物的性质及计算,综合性强,要求学生熟练掌握基础知识才能很好的解答本题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

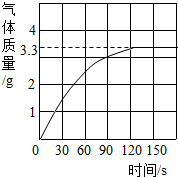 某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到12.5g水垢中,产生CO2气体的情况如图所示.提示:反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑ Mg(OH)2+2HCl═MgCl2+2H2O
某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到12.5g水垢中,产生CO2气体的情况如图所示.提示:反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑ Mg(OH)2+2HCl═MgCl2+2H2O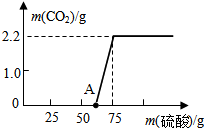 某校研究性学习小组进行了一个有趣的实验探究:
某校研究性学习小组进行了一个有趣的实验探究: