题目内容
4.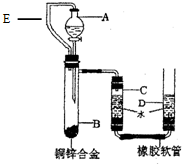 某化学小组要研究金属的性质及合金的组成.
某化学小组要研究金属的性质及合金的组成.(1)应用金属活动性顺序能帮助我们进一步学习金属的性质.
已知下列三组物质间均能发生置换反应.
A.Fe和CuSO4溶液 B.Mg和MnSO4溶液 C.Mn和FeSO4溶液
写出Mn、Fe、Mg、Cu四种金属的活动性由强到弱的顺序是Mg>Mn>Fe>Cu.
(2)测定铜锌合金中铜的质量分数
①甲同学取铜锌合金粉末65g放于烧杯中,再加入100g足量的稀盐酸,充分反应后称得烧杯中剩余物质量为164.6g,请通过计算求出该合金中铜的质量分数.
②乙同学利用右图装置测定铜锌合金中锌的质量分数.主要实验步骤如下(必要的固定装置已略去);
Ⅰ.连接装置并检查装置气密性;
Ⅱ.加入药品和水;
Ⅲ.记录C中液面刻度(C为带有刻度的玻璃管);
Ⅳ.由A向B中滴加试剂至过量;
Ⅴ.待B中不再有气体产生并恢复至室温后,记录C中液面刻度,
计算得到气体的体积为V mL(经查,该气体密度为ρg/L);
Ⅵ.将B中剩余固体过滤、洗涤、干燥并称重,称得剩余固体质量为W g.
回答:
A仪器的名称为分液漏斗;
乙同学在实验前将块状的铜锌合金磨成粉末状,其目的是:加快反应速率,使反应更充分;
为使测得的气体体积更精确,记录C中液面刻度时,除使视线与凹液面的最低处相平外,还应使D、C中的液面相平;
乙同学发现实验中由于缺少某一步骤导致数据缺乏而无法计算,该步骤是:测量铜锌合金样品的质量;
乳胶管E的作用是防止分液漏斗中液体进入试管导致测量的氢气体积偏大.
分析 (1)根据金属活动性顺序可知,排在前面的金属会将排在后面的金属从其盐溶液中置换出来进行分析;
(2)①根据质量守恒定律计算生成氢气的质量,然后依据化学方程式计算参加反应的锌的质量,再计算铜
②根据实验室常用仪器的名称进行分析;
根据增大反应物的接触面积,可以加快反应速率进行分析;
为使测得的气体体积更精确,记录C中液面刻度时,除使视线与凹液面的最低处相平外,还应D处观察上升的是否与C中下降的一致,以尽量减少误差;
已知气体的体积,根据密度,可以求出气体的质量;又知道剩余固体质量为Wg,但不知道原固体的质量,无法计算.所以实验中由于缺少某一步骤导致数据缺乏而无法计算,该步骤是:测量铜锌合金的总质量;
根据实验装置中乳胶管的作用进行分析.
解答 解:(1)下列三组物质间均能发生置换反应,
A.Fe和CuSO4溶液 B.Mg和MnSO4溶液 C.Mn和FeSO4溶液
所以Mn、Fe、Mg、Cu四种金属的活动性由强到弱的顺序是:Mg>Mn>Fe>Cu;
(2)①生成氢气的质量是:100g+65g-164.6g=0.4g,
设参加反应的锌的质量为x,
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.4g
$\frac{65}{x}$=$\frac{2}{0.4g}$
x=13g,
所以该合金中铜的质量分数是:$\frac{65g-13g}{65g}$×100%=80%;
②通过分析可知,A是分液漏斗;
铜锌合金磨成粉末状,其目的是:接触面积大,充分反应;目的为了提高反应速率;
除使视线与凹液面的最低处相平外,还应D处观察上升的是否与C中下降的一致;
已知气体的体积,根据密度,可以求出气体的质量;又知道剩余固体质量为Wg,但不知道原固体的质量,无法计算.实验中由于数据缺乏而无法计算,该步骤是:测量铜锌合金的总质量;
通过分析可知,乳胶管E的作用是:防止分液漏斗中液体进入试管导致测量的氢气体积偏大.
故答案为:(1)Mg>Mn>Fe>Cu;
(2)①13g,80%;
②分液漏斗;
加快反应速率,使反应更充分;
使D、C中的液面相平;
测量铜锌合金样品的质量;
防止分液漏斗中液体进入试管导致测量的氢气体积偏大.
点评 本题主要考查了金属的化学性质和一些实验的操作注意事项,掌握检验该装置的气密性的方法,了解量气的装置.

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案| 四种物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量(g) | 30 | 18 | 2 | 5 |
| 反应后质量(g) | 16 | 未测 | 2 | 22 |
| A. | 未测值为3g | B. | 丙一定是催化剂 | ||
| C. | 乙全部发生了反应 | D. | 甲与乙反应的质量比为14:3 |
| A. | 硫在氧气中燃烧时,发出微弱的淡蓝色火焰 | |
| B. | 木炭在氧气中燃烧时,生成能使澄清石灰水变浑浊的二氧化碳 | |
| C. | 细铁丝在氧气中燃烧时,火星四溅,生成黑色固体 | |
| D. | 红磷在空气中燃烧时,产生大量白色烟雾 |
| A. | 一定是单质 | B. | 一定是纯净物 | C. | 一定不是化合物 | D. | 一定不是混合物 |
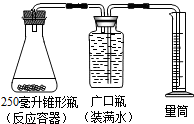 某同学采用如图装置,用一些植物的器官来代替MnO2作催化剂,分解H2O2制取氧气(2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑),记录数据如表.
某同学采用如图装置,用一些植物的器官来代替MnO2作催化剂,分解H2O2制取氧气(2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑),记录数据如表.| 序号 | H2O2溶液的 质量(克) | H2O2溶液的 溶质质量分数 | 植物的器官及质量 | 收集气体的体积(毫升) | 收集气体的时间(分钟) |
| 1 | 34 | 15% | 大颗粒胡萝卜16克 | 80 | 18 |
| 2 | 34 | 15% | 大颗粒马铃薯16克 | 80 | 10.5 |
| 3 | 34 | 15% | 小颗粒马铃薯16克 | 80 | 4 |
(1)要使胡萝卜能够更快地促进过氧化氢的分解,可采用的方法是将胡萝卜切成更小的颗粒.
(2)当量筒内的水达到250毫升时,打开广口瓶的 橡皮塞,立即将带火星的木条伸入瓶内,却发现木条不能复燃. 请你解释木条不能复燃的原因是:氧气的纯度不够高.
(3)34克15%的H2O2的质完全分解,能制得氧气2.4克.已知标准气压下氧气的密度是1.43克/升,则制得的氧气体积是1.678×10-3米3.
| A. | 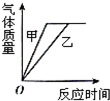 | B. | 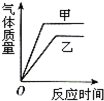 | C. | 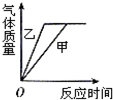 | D. | 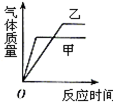 |
实验一:利用图1所示的实验装置,在直玻璃管内收集满干燥氧气.(实验说明:该套装置气密性良好.在收集氧气时,止水夹K1和K2都处于打开状态,当收集满氧气后,同时关闭止水夹Kl和K2,备用)
实验二:利用图2所示的实验装置,探究铁生锈的条件.(实验说明:在止水夹K1和K2保持关闭的前提下,在充满干燥氧气的直玻璃管两端各连接一小试管D、E.其中D试管内装有干燥的铁丝,E试管内为用冷却后的沸水浸过的铁丝.且该套装置气密性良好,并忽略两支小试管内少量空气对实验的影响)
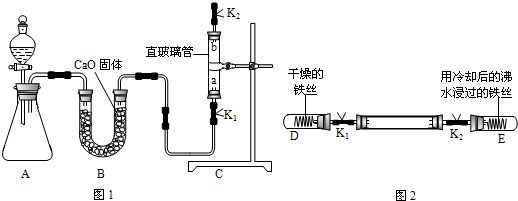
根据上述实验,回答下列问题:
| 实验步骤 | 实验现象 | 实验结论 |
| ①关闭K1和K2,观察试管内的铁丝 | (1)铁丝不生锈 | 铁只与水接触不生锈 |
| (2)打开止水夹K1,观察D试管内的铁丝 | 铁丝不生锈 | 铁之与氧气接触,不生锈 |
| ③打开止水夹K2,观察E试管内的铁丝 | 铁丝生锈 | (3)铁同时与水、氧气接触,才生锈 |
| 物质(杂质) | 所用试剂及操作 | |
| A | 氧化铜(木炭粉) | 在氧气流中加热 |
| B | 氯化亚铁溶液(氯化铜) | 加入足量的铁粉,充分反应后过滤 |
| C | 二氧化锰(氯化钾) | 溶解,过滤,洗涤,烘干 |
| D | 二氧化碳(氯化氢气体) | 通入氢氧化钠溶液,干燥 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 原子中一定含有质子、中子、电子 | |
| B. | 单质中只含有一种元素,因此只含有一种元素的物质一定是单质 | |
| C. | 稀有气体元素的原子最外层电子数为8(氦除外),因此微粒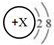 一定是稀有气体元素的原子 一定是稀有气体元素的原子 | |
| D. | 补铁酱油、高钙牛奶中的“铁”、“钙”指的是元素 |