题目内容
4.我市拥有丰富的海洋资源,开发利用这些宝贵的资源有力地促进了我市经济的发展.(1)从海水中提取出的粗盐中除了NaCl外,还含有泥沙等杂质,请完善下列实验室中除去泥沙等杂质的实验步骤,并回答相关问题:
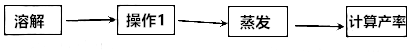
其中操作1的名称是过滤,该操作中用到的玻璃仪器有烧杯、玻璃棒、漏斗(填仪器名称);在加热蒸发过程中,当蒸发皿中出现较多固体时,停止加热.
(2)实验结束,小组同学发现溶解的粗盐质量为5.1g,蒸发后精盐质量为5.2g,其原因可能是CD.
A.粗盐未充分溶解就过滤 B.蒸发时未用玻璃棒搅拌
C.蒸发后,所得的精盐较潮湿 D.称量精盐时,精盐与砝码放反了
(3)查阅资料得知:海水提取出粗盐后的母液中,还含有较多的氯化镁,用氯化镁可制得金属镁.工业上从母液中提取氯化镁的过程如下:
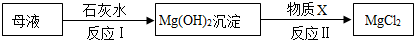
则物质X是盐酸(填名称).
(4)工业上可用电解饱和NaCl溶液的方法制得氯气、氢气和一种碱,请写出该碱的化学式NaOH,你猜想的依据是质量守恒定律.
分析 (1)实验室中除去泥沙等杂质时,实验步骤是溶解、过滤蒸发,过滤操作中用到的玻璃仪器有烧杯、玻璃棒、漏斗;
在加热蒸发过程中,当蒸发皿中出现较多固体时,停止加热;
(2)A.粗盐未充分溶解就过滤,会导致蒸发后精盐质量偏小;
B.蒸发时未用玻璃棒搅拌,会导致部分氯化钠损失,从而导致蒸发后精盐质量偏小;
C.蒸发后,所得的精盐较潮湿,会导致蒸发后精盐质量偏大;
D.称量精盐时,精盐与砝码放反了,会导致称量结果偏大;
(3)氢氧化钙和氯化镁反应生成氢氧化镁沉淀和氯化钙,稀盐酸和氢氧化镁反应生成氯化镁和水;
(4)化学反应遵循质量守恒定律,即反应前后元素种类不变,原子种类和总个数都不变.
解答 解:(1)操作1的名称是过滤,该操作中用到的玻璃仪器有烧杯、玻璃棒、漏斗;
在加热蒸发过程中,当蒸发皿中出现较多固体时,停止加热.
故填:过滤;漏斗;出现较多固体.
(2)A.粗盐未充分溶解就过滤,会导致蒸发后精盐质量偏小;
B.蒸发时未用玻璃棒搅拌,会导致部分氯化钠损失,从而导致蒸发后精盐质量偏小;
C.蒸发后,所得的精盐较潮湿,会导致蒸发后精盐质量偏大;
D.称量精盐时,精盐与砝码放反了,会导致称量结果偏大.
故填:CD.
(3)氢氧化钙和氯化镁反应生成氢氧化镁沉淀和氯化钙,稀盐酸和氢氧化镁反应生成氯化镁和水,因此物质X是盐酸.
故填:盐酸.
(4)因为反应物中金属元素只有钠元素,因此电解饱和NaCl溶液生成的碱是氢氧化钠,猜想的依据是质量守恒定律.
故填:NaOH;质量守恒定律.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

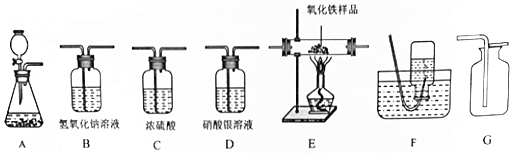
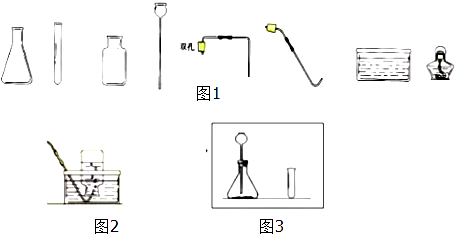
(1)第一组的同学用过氧化氢溶液和二氧化锰 制取氧气.
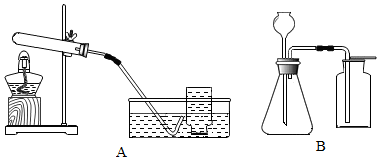
①制取并收集一瓶干燥的氧气,所选仪器的连接顺序为ACG(填写仪器序号字母).
②用过氧化氢溶液和二氧化锰制取氧气的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
③制取气体前,需要检查仪器A的气密性,其具体操作步骤是关闭阀门,将导管一端放入水中,用水捂住锥形瓶,一段时间后,若水中的导管口有气泡冒出,手松开,水会倒流进导管口一段距离,则说明气密性良好.
(2)第二组同学欲用一种混合气体(可能含有H2、CO、H2O、HCl中的一种或几种),测定某10g氧化铁样品中的氧化铁的质量分数.实验时,所选仪器的连接顺序是“混合气体→D→C1→E→C2→B→碱石灰干燥管”,样品充分反应,测定部分装置反应前后的质量变化,并绘制了如下表格(假设样品中杂质不挥发,也不发生化学反应:已知:Fe2O3+3H2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3H2O).
| 装置编号 | D | C1 | C2 | B |
| 试剂 | 硝酸银溶液 | 浓硫酸 | 浓硫酸 | 氢氧化钠溶液 |
| 现象或质量变化 | 无明显现象 | 增重1.0g | 增重2.7g | 增重0.66g |
①装置E中能观察到的明显现象是红色固体变黑.
②装置B中发生反应的化学方程式为CO2+2NaOH=Na2CO3+H2O.
③根据以上现象判断,混合气体中一定不存在的气体是氯化氢(填物质名称).
④该氧化铁样品中氧化铁的质量分数是88%.
| A. | Na+、H+、Cl-、HCO3- | B. | K+、Na+、Cl-、NO3- | ||
| C. | H+、Na+、OH-、SO42- | D. | Ag+、Ca2+、NO3-、Cl- |