题目内容
16.某面包膨松剂由碳酸氢钠和碳酸氢铵两种物质组成.化学小组为验证该膨松剂的成分及各成分含量的测定,通过查阅资料,设计如图所示实验.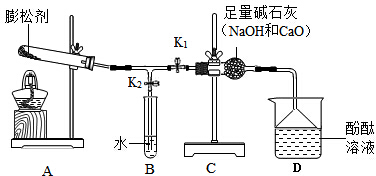
查阅资料:
①膨松剂在面包制作过程中发生的两个化学反应的方程式分别是:
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑
②通常状况下,1体积水溶解700体积氨气,氨气溶于水所得溶液为氨水
③二氧化碳溶于水,溶液呈酸性
实验定性验证:
| 操 作 步 骤 | 实 验 现 象 | 实 验 结 论 |
| 组装仪器,检查装置的气密性 | ||
| 装入药品进行加热,打开阀 门K1、关闭阀门K2. | 观察到酚酞试液变红 | 则说明有碳酸氢铵存在 |
| 然后打开阀门K2、关闭阀门 K1继续加热 | 最终观察到B中试管内没有气泡冒出,且原药品中仍有固体残留物. | 则说明有碳酸氢钠存在 |
(1)同学甲认为应将装置B中水换成澄清石灰水,才能判断样品的成分.同学乙认为没有必要,他的理由是试管中的水只是判断反应是否完全.
(2)请你分析装置C中碱石灰的作是吸收二氧化碳,避免干扰对碳酸氢铵的检验.
实验数据分析及成分含量计算:
小组同学利用电子天平共同作了以下测定实验,实验数据记录如下:
| 称 量 项 目 | 称 量 时 间 | 质量(g) |
| 装置A中试管质量 | 反应前 | 50.00 |
| 装置A中试管+样品质量 | 反应前 | 70.00 |
| 装置A中试管+固体质量 | 反应后 | 60.60 |
解:设碳酸氢钠的质量为x,
碳酸氢钠受热分解生成碳酸钠的质量为:60.60g-50.00g=10.60g,
样品质量为:70.00g-50.00g=20.00g,
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,
168 106
x10.60g
$\frac{168}{x}$=$\frac{106}{10.60g}$,
x=16.8g,
该膨松剂中碳酸氢铵的质量分数为:$\frac{20.00g-16.8g}{20.00g}$×100%=16%,
答:该膨松剂中碳酸氢铵的质量分数为16%.
分析 实验定性验证:
组装完实验仪器后,要先检查装置的气密性,以防装置漏气影响实验;
加热碳酸氢铵分解生成氨气、水和二氧化碳,氨气溶于水显碱性,可使酚酞变红;
碳酸氢钠分解生成碳酸钠固体和水、二氧化碳;
实验分析及反思:
(1)水的作用是判断反应是否进行完全,没有气泡说明反应完,所以没有必要换成石灰水;
(2)二氧化碳溶于水形成碳酸,可以和氨水发生反应,如果不除去二氧化碳,会影响对氨气的判断,进一步会影响对碳酸氢铵的判断;
反应后试管中的固体质量即为反应生成碳酸钠的质量,根据碳酸钠的质量可以计算碳酸氢钠的质量,根据碳酸氢钠的质量可以计算碳酸氢铵的质量,进一步可以计算该膨松剂中碳酸氢铵的质量分数.
解答 解:实验定性验证:
组装好仪器,先检查装置的气密性,如果导管口产生气泡,说明装置不漏气;
装入药品进行加热,打开阀门K1、关闭阀门K2,如果观察到酚酞试液变红色,说明有碳酸氢铵存在;
然后打开阀门K2、关闭阀门K1继续加热,最终观察到B中试管内没有气泡冒出,且原药品中仍有固体残留物,说明有碳酸氢钠存在.
故填:
| 操 作 步 骤 | 实 验 现 象 | 实 验 结 论 |
| 组装仪器,检查装置的气密性 | ||
| 装入药品进行加热,打开阀 门 K1、关闭阀门K2. | 观察到酚酞试液变红 | 则说明有碳酸氢铵存在 |
| 然后打开阀门K2、关闭阀门 K1继续加热 | 最终观察到B中试管内没有气泡冒出,且原药品中仍有固体残留物. | 则说明有碳酸氢钠存在 |
(1)同学甲认为应将装置B中水换成澄清石灰水,才能判断样品的成分.同学乙认为没有必要,他的理由是试管中的水只是判断反应是否完全.
故填:试管中的水只是判断反应是否完全.
(2)装置C中碱石灰的作用是吸收二氧化碳,避免干扰对碳酸氢铵的检验.
故填:吸收二氧化碳,避免干扰对碳酸氢铵的检验.
实验数据分析及成分含量计算:
解:设碳酸氢钠的质量为x,
碳酸氢钠受热分解生成碳酸钠的质量为:60.60g-50.00g=10.60g,
样品质量为:70.00g-50.00g=20.00g,
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,
168 106
x 10.60g
$\frac{168}{x}$=$\frac{106}{10.60g}$,
x=16.8g,
该膨松剂中碳酸氢铵的质量分数为:$\frac{20.00g-16.8g}{20.00g}$×100%=16%,
答:该膨松剂中碳酸氢铵的质量分数为16%.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
相关题目
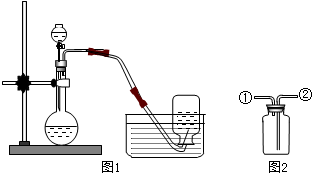
6.如图1是实验室用过氧化氢分解制取氧气并用排水法收集的实验.请按要求回答问题:
(1)检验该气体是否为氧气的方法是将带火星的木条伸入瓶中,若木条能复燃,说明是氧气.
(2)若用如图2的装置来收集干燥的氧气,氧气应从②进入.(填①或②)
(3)实验之后,该同学展开探究:催化剂二氧化锰的用量对反应速率有怎样的影响?他做了这样一组实验,每次均用30毫升10%的H2O2溶液,使用不同量的二氧化锰粉末做催化剂,测定每次收集700毫升氧气所用的时间,结果如下:
从表中数据看出:二氧化锰的用量对反应速率有影响,描述二氧化锰的用量对反应速率有怎样的影响在一定范围内,二氧化锰的用量越大,反应越快,超过一定量时,反应速度不变.
(4)如果在实验中忘了加入二氧化锰,下列对实验结果的描述正确的是C.
A、不影响化学反应速率 B、氧气总量不变,但是反应速率慢
C、氧气总量变少,且反应速率慢 D、无法产生氧气
(5)若实验室要制取1.6克氧气,理论上需要多少克溶质质量分数为10%的过氧化氢溶液?
(1)检验该气体是否为氧气的方法是将带火星的木条伸入瓶中,若木条能复燃,说明是氧气.
(2)若用如图2的装置来收集干燥的氧气,氧气应从②进入.(填①或②)

(3)实验之后,该同学展开探究:催化剂二氧化锰的用量对反应速率有怎样的影响?他做了这样一组实验,每次均用30毫升10%的H2O2溶液,使用不同量的二氧化锰粉末做催化剂,测定每次收集700毫升氧气所用的时间,结果如下:
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 二氧化锰粉末用量(克) | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 | 1.0 |
| 所用时间(秒) | 17 | 8 | 7 | 5 | 4 | 3 | 2 | 2 | 2 | 2 |
(4)如果在实验中忘了加入二氧化锰,下列对实验结果的描述正确的是C.
A、不影响化学反应速率 B、氧气总量不变,但是反应速率慢
C、氧气总量变少,且反应速率慢 D、无法产生氧气
(5)若实验室要制取1.6克氧气,理论上需要多少克溶质质量分数为10%的过氧化氢溶液?
7.某兴趣小组的同学用图1所示装置制取氧气,然后进一步探究有关氧气的性质.请回答:
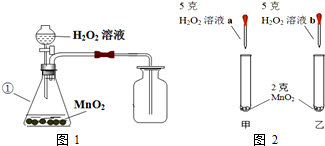
(1)写出编号为①的仪器名称:锥形瓶.
(2)某同学根据图2进行实验,观察到甲试管中产生气泡比乙试管中产生气泡多.你认为原因是a溶液比b溶液浓.
(3)20℃,市售的双氧水的浓度为10%,其中溶质和溶剂的质量比为1:9.取市售的20mL质量分数为10%的双氧水,加一定质量的水稀释成3%的双氧水.从如表中找出配制过程中需要用到的数据:1.024g/mL.最终可稀释得到68.3克3%的双氧水.(保留至0.01%)
(4)取34克未知浓度的双氧水与2克MnO2混合制取氧气,完全反应至质量不再减轻后,称量剩余混合物的质量为35.2克.
①反应中生成氧气的质量为0.8g.
②根据化学方程式,计算该双氧水中溶质H2O2的质量.
③该双氧水的溶质质量分数为5%.

(1)写出编号为①的仪器名称:锥形瓶.
(2)某同学根据图2进行实验,观察到甲试管中产生气泡比乙试管中产生气泡多.你认为原因是a溶液比b溶液浓.
(3)20℃,市售的双氧水的浓度为10%,其中溶质和溶剂的质量比为1:9.取市售的20mL质量分数为10%的双氧水,加一定质量的水稀释成3%的双氧水.从如表中找出配制过程中需要用到的数据:1.024g/mL.最终可稀释得到68.3克3%的双氧水.(保留至0.01%)
| 溶质质量分数 | 10% | 3% |
| 密度(单位g/mL) | 1.024 | 0.991 |
①反应中生成氧气的质量为0.8g.
②根据化学方程式,计算该双氧水中溶质H2O2的质量.
③该双氧水的溶质质量分数为5%.
4.水变成水蒸气,这是因为( )
| A. | 构成水的微粒变成了其他的微粒 | |
| B. | 构成水的微粒不断运动扩散到空气中去 | |
| C. | 构成水的微粒被分解 | |
| D. | 构成水的微粒被阳光吸收 |
1.把下列各组物质的溶液相混合,再加入足量的盐酸,有沉淀生成的是( )
| A. | NaOH FeCl3 | B. | Ca(OH)2 Na2CO3 | C. | AgNO3 NaNO3 | D. | CuCl2 Ba(OH)2 |
8.掌握化学用语是学好化学的关键.下列化学用语与含义相符的是( )
| A. | 2CO-----两个一氧化碳分子 | B. | 2H----2个氢元素 | ||
| C. | O2-------2个氧原子 | D. | $\stackrel{+1}{Na}$--钠离子 |
5.下列操作中,正确的是( )
| A. |  向试管中滴加液体 | B. |  读取量筒的读数 | ||
| C. |  吹灭酒精灯 | D. |  向试管中加固体粉末 |
6.类推是学习中常用的思维方法,现有以下类推结果,其中正确的是( )
| A. | 含有氧元素的物质分解可能产生氧气,能分解产生氧气的物质一定含有氧元素 | |
| B. | 置换反应一定有单质和化合物生成,有单质和化合物生成的一定是置换反应 | |
| C. | 氧化物一定含有氧元素,所以含有氧元素的物质一定是氧化物 | |
| D. | 活泼金属中滴加稀盐酸有气泡产生,滴加稀盐酸有气泡产生的物质一定是活泼金属 |

