题目内容
12.有一气体可能是CO、CO2、H2、HCl气体的混合物,依次通过(1)澄清的石灰水时,无沉淀生成,通过(2)灼热的氧化铜,黑色粉末变成红色物质,但无水珠出现.将剩余气体再通入澄清的石灰水时,则有白色沉淀生成(假设上述各步中的气体完全反应).请回答:(1)混合气体中,一定不存在H2,可能存在CO2、HCl;
(2)写出黑色粉末变成红色物质的化学反应方程式CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2.
分析 由题目的信息可知:通过(2)灼热的氧化铜,黑色粉末变成红色物质,但无水珠出现,说明一定没有氢气,一定有一氧化碳;将剩余气体再通入澄清的石灰水时,则有白色沉淀生成,说明原混合气体中可能有CO2、HCl;一氧化碳和氧化铜在加热的条件下生成铜和二氧化碳,因此黑色粉末变成红色物质.
解答 解:(1)通过(2)灼热的氧化铜,黑色粉末变成红色物质,但无水珠出现,说明一定没有氢气,一定有一氧化碳;将剩余气体再通入澄清的石灰水时,则有白色沉淀生成,说明原混合气体中可能有CO2、HCl;故答案为:H2; CO2、HCl;
(2)一氧化碳和氧化铜在加热的条件下生成铜和二氧化碳,因此黑色粉末变成红色物质,故答案为:CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2
点评 本考点考查了常见气体的鉴别方法,要充分利用气体本身的性质,按照操作、现象和结论的流程来描述,不同的气体会出现不同的现象.在叙述鉴别方法时,要注意语言描述的严密性,要记住由现象得出结论.本考点在中考中经常出现,主要出现在选择题和实验题中.

练习册系列答案
相关题目
3.下列实验探究得出的结论中,不正确的是( )
| A. | 将铁片放入硫酸铜溶液中,可以判断金属活动性:铁>铜 | |
| B. | 将石蕊滴到都为无色的石灰水与稀盐酸中,如果变红可推知为稀盐酸 | |
| C. | 通过观察小木棍蘸少量浓硫酸的现象,可以推知浓硫酸具有腐蚀性 | |
| D. | 通过测定雨水的pH值为6.5,可以判断该雨水为酸雨 |
20.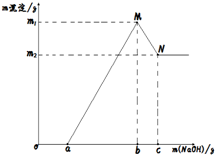 已知:MgSO4+2NaOH═Mg(OH)2+Na2SO4,Al2(SO4)3+6NaOH═2Al(OH)3+3Na2SO4,Al(OH)3+NaOH═NaAlO2+2H2O,Mg(OH)2不溶于NaOH溶液,现剪取wg镁铝合金的易拉罐壳,先用过量硫酸溶解,然后再向溶液中滴加NaOH溶液,反应符合下列图象关系(横坐标表示滴加NaOH溶液的质量,纵坐标表示生成沉淀质量),则下列说法不正确的是( )
已知:MgSO4+2NaOH═Mg(OH)2+Na2SO4,Al2(SO4)3+6NaOH═2Al(OH)3+3Na2SO4,Al(OH)3+NaOH═NaAlO2+2H2O,Mg(OH)2不溶于NaOH溶液,现剪取wg镁铝合金的易拉罐壳,先用过量硫酸溶解,然后再向溶液中滴加NaOH溶液,反应符合下列图象关系(横坐标表示滴加NaOH溶液的质量,纵坐标表示生成沉淀质量),则下列说法不正确的是( )
 已知:MgSO4+2NaOH═Mg(OH)2+Na2SO4,Al2(SO4)3+6NaOH═2Al(OH)3+3Na2SO4,Al(OH)3+NaOH═NaAlO2+2H2O,Mg(OH)2不溶于NaOH溶液,现剪取wg镁铝合金的易拉罐壳,先用过量硫酸溶解,然后再向溶液中滴加NaOH溶液,反应符合下列图象关系(横坐标表示滴加NaOH溶液的质量,纵坐标表示生成沉淀质量),则下列说法不正确的是( )
已知:MgSO4+2NaOH═Mg(OH)2+Na2SO4,Al2(SO4)3+6NaOH═2Al(OH)3+3Na2SO4,Al(OH)3+NaOH═NaAlO2+2H2O,Mg(OH)2不溶于NaOH溶液,现剪取wg镁铝合金的易拉罐壳,先用过量硫酸溶解,然后再向溶液中滴加NaOH溶液,反应符合下列图象关系(横坐标表示滴加NaOH溶液的质量,纵坐标表示生成沉淀质量),则下列说法不正确的是( )| A. | a点表示NaOH溶液与剩余的硫酸恰好完成反应 | |
| B. | 在M点时,溶液中有两种溶质 | |
| C. | N点表示Al(OH)3沉淀刚好完成溶于NaOH溶液 | |
| D. | 生成氢氧化镁沉淀的质量为(m1-m2)g |
2.铜镁合金具有优良的导电性,常用作飞机天线等导电材料.科研小组欲测定合金的组成(其他元素忽略不计),进行如下实验:取铜合金10克放入烧杯,将140克稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体的质量,数据记录如表.请计算:
(1)合金中镁与铜的质量比为13:7.
(2)4次实验中剩余固体减少量不相同的原因是第4次中硫酸没能完全反应.
(3)所加稀硫酸的溶质的质量分数.(写出计算过程)
| 次数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸质量/克 | 35 | 35 | 35 | 35 |
| 剩余固体质量/克 | 9.1 | 8.2 | 7.3 | 6.5 |
(2)4次实验中剩余固体减少量不相同的原因是第4次中硫酸没能完全反应.
(3)所加稀硫酸的溶质的质量分数.(写出计算过程)


 有一乡村中学由于条件所限,仅有一大一小两种试管和稀硫酸.甲、乙两个学生找来铝制废牙膏皮,各自设计了一种装置,制取并收集一试管氢气.那么其中乙学生设计的装置比较合理.用较合理的装置制取氢气时,要使氢气充满收集氢气的试管,在不增减仪器的条件下,应该采取的措施是先将小试管贴近大试管底部,随着气泡的生成,慢慢将小试管向下降或将大试管向上升高.
有一乡村中学由于条件所限,仅有一大一小两种试管和稀硫酸.甲、乙两个学生找来铝制废牙膏皮,各自设计了一种装置,制取并收集一试管氢气.那么其中乙学生设计的装置比较合理.用较合理的装置制取氢气时,要使氢气充满收集氢气的试管,在不增减仪器的条件下,应该采取的措施是先将小试管贴近大试管底部,随着气泡的生成,慢慢将小试管向下降或将大试管向上升高.