题目内容
8.为了除去粗盐中的Ca2+、Mg2+、SO42-等离子,可将粗盐溶于水后进行如下操作:①加入适量盐酸,②加过量NaOH溶液,③加过量Na2CO3溶液,④加过量BaCl2溶液,⑤过滤.下列操作顺序合理的是( )| A. | ②③④⑤① | B. | ④③②①⑤ | C. | ④②③①⑤ | D. | ②④③⑤① |
分析 根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,进行分析解答.
解答 解:镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可溶液以将镁离子沉淀;硫酸根离子用钡离子沉淀,加入过量的氯化钡溶液可以将硫酸根离子沉淀;至于先除镁离子,还是先除硫酸根离子都可以;钙离子用碳酸根离子沉淀,除钙离子加入过量的碳酸钠溶液转化为沉淀,但是加入碳酸钠溶液要放在加入的氯化钡溶液之后,这样碳酸钠会除去反应剩余的氯化钡;完全反应后,再进行过滤,最后再加入适量盐酸除去反应剩余的氢氧根离子和碳酸根离子,故正确的顺序为:②④③⑤①或④②③⑤①.
故选:D.
点评 本题难度较大,考查了粗盐提纯中离子的除杂,除去多种杂质离子时,要考除杂的顺序、后面加入的试剂要能除去前面加入的过量的试剂.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.为比较相同浓度的FeCl3溶液和CuSO4溶液对H2O2分解的速率影响效果,某研究小组进行了如下探究:
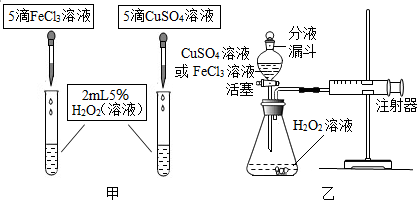
【定性研究】
(1)如图甲,可通过观察产生气泡的速率来定性比较两者的速率影响效果.
【定量研究】
(2)如图乙,实验前检查该装置气密性的方法是先关闭分液漏斗,将注射器活塞向外拉,再松开手活塞又回到原来的位置,则装置气密性良好.要定量比较两者的速率影响效果,可测量生成等体积气体所需的时间.
【深入研究】
(3)在FeCl3溶液中,究竟是哪种粒子影响过氧化氢的分解速率?
猜想1:水分子(H2O)影响过氧化氢的分解速率;
猜想2:氯离子(Cl-)影响过氧化氢的分解速率;
猜想3:铁离子(Fe3+)影响过氧化氢的分解速率;…
请设计实验,验证猜想
(4)【反思与讨论】上述实验确实可以证明Fe3+可以改变过氧化氢的分解速率,但不能证明FeCl3是过氧化氢分解的催化剂.若要证明FeCl3是过氧化氢分解的催化剂,还需要通过实验证明FeCl3在反应前后质量和化学性质不变.
请写出FeCl3催化H2O2分解的化学方程式2H2O2$\frac{\underline{\;FeCl_{3}\;}}{\;}$2H2O+O2↑.

【定性研究】
(1)如图甲,可通过观察产生气泡的速率来定性比较两者的速率影响效果.
【定量研究】
(2)如图乙,实验前检查该装置气密性的方法是先关闭分液漏斗,将注射器活塞向外拉,再松开手活塞又回到原来的位置,则装置气密性良好.要定量比较两者的速率影响效果,可测量生成等体积气体所需的时间.
【深入研究】
(3)在FeCl3溶液中,究竟是哪种粒子影响过氧化氢的分解速率?
猜想1:水分子(H2O)影响过氧化氢的分解速率;
猜想2:氯离子(Cl-)影响过氧化氢的分解速率;
猜想3:铁离子(Fe3+)影响过氧化氢的分解速率;…
请设计实验,验证猜想
| 实验操作 | 实验现象 | 实验结论 |
| 分别取同温度同体积同浓度的H2O2溶液于2支试管中,再分别加入等质量的FeCl3和NaCl.观察现象. | 加入FeCl3的试管中产生的气体快,加入NaCl的试管中产生的气体慢. | 证明是Fe3+影响过氧化氢的分解速率 |
请写出FeCl3催化H2O2分解的化学方程式2H2O2$\frac{\underline{\;FeCl_{3}\;}}{\;}$2H2O+O2↑.
3.下列气体能供给呼吸,支持燃烧的是( )
| A. | 氮气 | B. | 氧气 | C. | 二氧化碳 | D. | 稀有气体 |
20.将100毫升水与100毫升酒精混合后,总体积( )
| A. | 大于200毫升 | B. | 等于200毫升 | C. | 小于200毫升 | D. | 等于180毫升 |
17.根据如图所示的甲、乙、丙三种固体物质的溶解度曲线判断,下列说法中不正确的是( )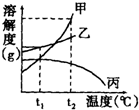

| A. | 将甲乙、丙、的饱和溶液分别从t1℃升高到t2℃,只有丙有晶体析出 | |
| B. | t2℃时,配制相同质量甲、乙、丙三种物质的溶液时,所需溶质的质量是甲>乙>丙 | |
| C. | 升高温度可以提高甲物质的溶解度 | |
| D. | 使乙从其饱和溶液中析出,可采用冷却热饱和溶液的方法 |
 A、B、C、D、E、F、G为初中化学常见的物质,其中B、E、G属于单质,反应②是以赤铁矿为原料炼铁工业中的主要反应,它们之间的相互转化关系如图所示:
A、B、C、D、E、F、G为初中化学常见的物质,其中B、E、G属于单质,反应②是以赤铁矿为原料炼铁工业中的主要反应,它们之间的相互转化关系如图所示: 物质A、B、C是初中化学中常见的物质,A、B、C中都含有一种共同的元素.它们有如图所示的转化关系.回答下列问题:
物质A、B、C是初中化学中常见的物质,A、B、C中都含有一种共同的元素.它们有如图所示的转化关系.回答下列问题: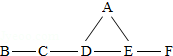 A、B、C、D、E、F分别是氧化铁、稀盐酸、氢氧化钙溶液、碳酸钠溶液、氢氧化钠溶液、二氧化碳中的一种,B不属于氧化物.他们之间有如图所示的反应关系,图中短线相连的物质间能发生反应.请回答
A、B、C、D、E、F分别是氧化铁、稀盐酸、氢氧化钙溶液、碳酸钠溶液、氢氧化钠溶液、二氧化碳中的一种,B不属于氧化物.他们之间有如图所示的反应关系,图中短线相连的物质间能发生反应.请回答