题目内容
13.某NaOH样品中含有KOH和不容易水和酸的杂质A物质,取样品5.6克,加入100g的稀盐酸溶液,充分反应后共生m克的水,那么根据上述信息下列说法正确的是( )| A. | 当m=1.8g时,样品中一定含有杂质A,可能含有KOH | |
| B. | 当m=1.8g时,样品中可能含有杂质A或可能含有KOH | |
| C. | 当m=1.8g时,盐酸的质量分数不能低于7.2% | |
| D. | 当m<1.8g时,样品中可能含有杂质A或可能含有KOH |
分析 假设5.6g全部为氢氧化钠,然后根据氢氧化钠和盐酸反应的化学方程式计算出能够生成的水的质量及消耗的盐酸中溶质的质量,然后结合题给的选项进行分析并作出判断.
解答 解:假设5.6g全部为氢氧化钠,则设生成水的质量为x,盐酸溶质的质量为y
NaOH+HCl═NaCl+H2O
40 36.5 18
5.6g y x
$\frac{40}{5.6g}$=$\frac{36.5}{y}$=$\frac{18}{x}$
解得:x=2.52g
y=5.11g
假设样品全部为氢氧化钾,则设生成水的质量为z
KOH+HCl═KCl+H2O
56 18
5.6g z
$\frac{56}{5.6g}$=$\frac{18}{z}$
解得:z=1.8g
A、因为全部为氢氧化钠生成水的质量为2.52g,所以若生成水的质量为1.8g,则说明在样品中一定含有杂质,当然其中也可能含有氢氧化钾,故A正确;
B、根据B的分析可以知道,若生成水的质量为1.8g,则说明在样品中一定含有杂质,但不可能只有含有氢氧化钾,因为,根据我们的计算可以知道,单独的氢氧化钠反应生成水的质量大于1.8g,而单独的氢氧化钾反应生成水的质量等于1.8g,所以如果样品中的杂质只含有氢氧化钾的话,生成的水的质量必然大于1.8g,故B错误;
C、若样品中不含有杂质,则根据与氢氧化钠反应的稀盐酸的质量可以计算出盐酸溶质的质量分数为:$\frac{5.11g}{100g}$×100%=5.11%,考虑到氢氧化钾的存在也会消耗一定质量的稀盐酸,所以可以判断稀盐酸的质量分数必然小于7.2%,故C错误;
D、因为全部为氢氧化钠生成水的质量为2.52g,全部是氢氧化钾,生成水的质量是1.8g,所以水不会小于1.8g,故D错误.
故选:A.
点评 把握住记录数据中在发生着变化的数据,分析数据变化的原因或变化的规律,这是分析实验数据的一种常用方法,也是这类题的解题关键.

 向一定量某固体中逐滴加入某溶液至过量,x轴表示加入溶液的质量.下列选项中y轴表示的含义与所给图象变化趋势一致的是( )
向一定量某固体中逐滴加入某溶液至过量,x轴表示加入溶液的质量.下列选项中y轴表示的含义与所给图象变化趋势一致的是( )| 选项 | 固 体 | 溶 液 | y 轴 含 义 |
| A | 二氧化锰 | 过氧化氢溶液 | 水的质量 |
| B | 大理石(杂质不反应) | 稀盐酸 | 固体中杂质的质量分数 |
| C | 铁粉与铜粉混合粉末 | 硫酸铜溶液 | 所得溶液中硫酸铜的质量 |
| D | 氯化钠与碳酸钠混合粉末 | 稀硫酸 | 二氧化碳的体积 |
| A. | A | B. | B | C. | C | D. | D |
 根据如图甲、乙、丙三种物质的转化关系,推测甲可能为下列四种物质中的( )
根据如图甲、乙、丙三种物质的转化关系,推测甲可能为下列四种物质中的( )| A. | 铜 | B. | 碳酸铜 | C. | 氧化铜 | D. | 氢氧化铜 |
 我国稀土资源丰富.今年三月起,美英日对我国的稀土资源虎视眈眈.铈(Ce)是一种常见的稀土元素,根据如图提供信息,下列关于铈的说法错误的是( )
我国稀土资源丰富.今年三月起,美英日对我国的稀土资源虎视眈眈.铈(Ce)是一种常见的稀土元素,根据如图提供信息,下列关于铈的说法错误的是( )| A. | 铈元素是非金属元素 | B. | 相对原子质量是140.1 | ||
| C. | 质子数为58 | D. | 原子序数是58 |

【提出问题】该批次的生石灰成分及含量是否与标签相符?(标签如图1所示)
【猜想与假设】固体成分为:
A:全部是碳酸钙和杂质 B:既有碳酸钙,也有氧化钙和杂质 C:氧化钙
【设计并完成实验】
| 实验操作 | 实验现象 | 实验结论 |
| 第一步操作:取少量固体于试管中,加适量水振荡后静置,再滴几滴无色酚酞试液 | 溶液变红 | 说明固体成分中一定含有①氧化钙 |
| 第二步操作:再取少量固体于另一试管中滴加过量稀盐酸 | 有气泡生成 | 说明固体成分中一定含有②碳酸钙 |
【定量测定】称取10克该批次的生石灰样品(图2),置于锥形瓶中,向其中缓慢加稀盐酸,直至无气泡产生,电子天平读数减小0.88克,将锥形瓶中残留物进行过滤、洗涤、干燥,得到固体质量为0.2克.通过计算求出生石灰的含量.
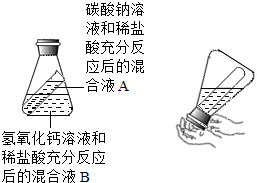 甲、乙两同学在学完酸的化学性质后,分别做了如下两个实验A、B.然后,他们又将各自的混合液混合.(先将锥形瓶慢慢倒转,使试管中的A液体流入锥形瓶B液体中)
甲、乙两同学在学完酸的化学性质后,分别做了如下两个实验A、B.然后,他们又将各自的混合液混合.(先将锥形瓶慢慢倒转,使试管中的A液体流入锥形瓶B液体中) 世界环保联盟建设全面禁止用氯气(常温下是一种黄绿色有毒气体)对饮用水消毒,推广使用安全、高效杀菌消毒剂ClO2.ClO2是一种黄绿色,有刺激性气味的气体,冷却至11.0℃以下时变成红色液体,易溶于水,见光易分解,易与碱反应,杀菌、漂白能力均优于氯气.
世界环保联盟建设全面禁止用氯气(常温下是一种黄绿色有毒气体)对饮用水消毒,推广使用安全、高效杀菌消毒剂ClO2.ClO2是一种黄绿色,有刺激性气味的气体,冷却至11.0℃以下时变成红色液体,易溶于水,见光易分解,易与碱反应,杀菌、漂白能力均优于氯气.