题目内容
5.如表为元素周期表中某一周期元素的原子结构示意图.请回答下列问题:
(1)表中磷原子的核电荷数x=15.
(2)在化学反应中,铝原子失去电子后形成铝离子的符号为Al3+.
(3)上述元素在周期表中处于同一横行(周期)的原因是电子层数相同.
(4)硫与氧气的反应(S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2)可用图表示:
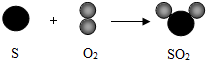
2m个氧气分子的质量为32g,则64g氧气与足量硫粉完全反应生成的二氧化硫分子数为4m.
分析 (1)根据原子中,核电荷数=质子数=核外电子数,进行分析解答.
(2)在化学反应中,铝原子易失去最外层上的3个电子电子形成带三个单位正电荷的铝离子;
(3)同一周期的元素具有相同的电子层数;
(4)由硫与氧气的反应可知其各物质的质量关系;2m个氧气分子的质量为32g,完全反应生成的二氧化硫分子数为2m个;则可求则64g氧气与足量硫粉完全反应生成的二氧化硫分子数.
解答 解:(1)原子中,核电荷数=质子数=核外电子数,则磷原子的核电荷数x=2+8+5=15.故填:15;
(2)在化学反应中,铝原子易失去最外层上的3个电子电子形成带三个单位正电荷的铝离子,铝离子的符号为Al3+;故填:Al3+;
(3)同一周期的元素具有相同的电子层数;故填:电子层数相同;
(4)由硫与氧气的反应(S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2),可知其各物质的质量关系;2m个氧气分子的质量为32g,完全反应生成的二氧化硫分子数为2m个;64g氧气含有4m个氧气分子,故64g氧气与足量硫粉完全反应生成的二氧化硫分子数为4m;故填:4.
点评 了解元素周期表的特点及其应用;了解原子结构示意图与离子结构示意图的特点;核外电子在化学反应中的作用;了解原子和离子的相互转化.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列选项中属于纯净物的是( )
| A. | 水 | B. | 空气 | C. | 食盐水 | D. | 石灰水 |
16.小明欲测量一石灰石中CaCO3的质量分数,将100g盐酸平均分5次加入到30g石灰石样品中(已知杂质不与盐酸反应也不溶于水,CaCO3与盐酸反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑),得到如下数据.
(1)第2次加入盐酸后,a为20克.
(2)石灰石样品中碳酸钙的质量是20克.
(3)第4次实验后生成的CaCl2溶液的溶质质量分数是多少?(列式计算,结果精确到0.1%)
| 次数 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
| 加入盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
| 剩余固体的质量/g | 25 | a | 15 | 10 | 10 |
(2)石灰石样品中碳酸钙的质量是20克.
(3)第4次实验后生成的CaCl2溶液的溶质质量分数是多少?(列式计算,结果精确到0.1%)
13.某NaOH样品中含有KOH和不容易水和酸的杂质A物质,取样品5.6克,加入100g的稀盐酸溶液,充分反应后共生m克的水,那么根据上述信息下列说法正确的是( )
| A. | 当m=1.8g时,样品中一定含有杂质A,可能含有KOH | |
| B. | 当m=1.8g时,样品中可能含有杂质A或可能含有KOH | |
| C. | 当m=1.8g时,盐酸的质量分数不能低于7.2% | |
| D. | 当m<1.8g时,样品中可能含有杂质A或可能含有KOH |
20.下列方框内是对某一主题知识的描述,其内容全部正确的一组是( )
| A安全常识 | B环保常识 |
| 安装燃气热水器定要配有烟道 预防煤气中毒室内放一盆水 劣质装饰材料---甲醛等超标致室内污染 | 减少汽车尾气污染使用乙醇汽油 深埋丢弃废旧电池造成水土污染 大理石雕塑被腐蚀温室效应所致 |
| C健康常识 | D生活常识 |
| 食用水果蔬菜可补充维生素 食用“加铁酱油”可预防贫血 食用加碘盐可预防甲状腺肿大 | 工业盐用来腌制凉果、酸菜等食物 化纤织物、纯毛织物用灼烧闻气味来 鉴别硬水和软水可用肥皂水来检验 |
| A. | A | B. | B | C. | C | D. | D |
10.化学与人类的衣、食、住、行密切相关.下列说法正确的是( )
| A. | 科学家用纳米线织出了碳纳米管布料,碳纳米管属于有机高分子材料 | |
| B. | 霉变的花生扔掉太浪费,可以压榨成花生油用于烹调食品 | |
| C. | 郊游后的自行车经清洗后需要晾晒并在链条上涂油等,目的是防止自行车生锈 | |
| D. | 用石灰乳粉刷过的墙日久变硬,是因为水分的蒸发而留下固体氢氧化钙的缘故 |
17.若用实验证明CuSO4溶液显蓝色不是由SO42-离子造成的.下列实验无意义的是( )
| A. | 观察K2SO4溶液的颜色 | |
| B. | 加水稀释后CuSO4溶液颜色变浅 | |
| C. | 向CuSO4溶液滴加适量的NaOH溶液,振荡后静置,溶液颜色消失 | |
| D. | 向CuSO4溶液滴加适量的BaCl2溶液,振荡后静置,溶液颜色未消失 |
14. 2015年央视“3•15晚会”曝光山东一些非法炼油厂生产有毒调和汽油,用90号汽油、石脑油、芳泾、甲缩醛等混合而成,其中不少化工原料在国家标准中明令禁止,如甲缩醛会造成汽车漏油、挥发有害气体,污染环境等.甲缩醛分子结构模型如图,下列关于甲缩醛的说法错误的是( )
2015年央视“3•15晚会”曝光山东一些非法炼油厂生产有毒调和汽油,用90号汽油、石脑油、芳泾、甲缩醛等混合而成,其中不少化工原料在国家标准中明令禁止,如甲缩醛会造成汽车漏油、挥发有害气体,污染环境等.甲缩醛分子结构模型如图,下列关于甲缩醛的说法错误的是( )
 2015年央视“3•15晚会”曝光山东一些非法炼油厂生产有毒调和汽油,用90号汽油、石脑油、芳泾、甲缩醛等混合而成,其中不少化工原料在国家标准中明令禁止,如甲缩醛会造成汽车漏油、挥发有害气体,污染环境等.甲缩醛分子结构模型如图,下列关于甲缩醛的说法错误的是( )
2015年央视“3•15晚会”曝光山东一些非法炼油厂生产有毒调和汽油,用90号汽油、石脑油、芳泾、甲缩醛等混合而成,其中不少化工原料在国家标准中明令禁止,如甲缩醛会造成汽车漏油、挥发有害气体,污染环境等.甲缩醛分子结构模型如图,下列关于甲缩醛的说法错误的是( )| A. | 甲缩醛的化学式为C2H4O2 | |
| B. | 甲缩醛由多种物质组成的混合物 | |
| C. | 甲缩醛中碳元素的质量分数最大 | |
| D. | 甲缩醛中碳元素与氧元素质量比为9:8 |
 如图所示,小试管中盛有水,U型管两侧内水面持平.向试管中加入某物质后,U型管两侧水面左低右高,则加入的物质为( )
如图所示,小试管中盛有水,U型管两侧内水面持平.向试管中加入某物质后,U型管两侧水面左低右高,则加入的物质为( )