题目内容
4.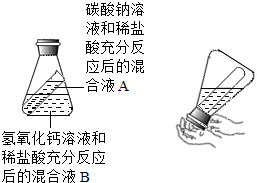 甲、乙两同学在学完酸的化学性质后,分别做了如下两个实验A、B.然后,他们又将各自的混合液混合.(先将锥形瓶慢慢倒转,使试管中的A液体流入锥形瓶B液体中)
甲、乙两同学在学完酸的化学性质后,分别做了如下两个实验A、B.然后,他们又将各自的混合液混合.(先将锥形瓶慢慢倒转,使试管中的A液体流入锥形瓶B液体中)(1)乙同学在做实验时没有观察到明显现象,于是对氢氧化钙溶液和稀盐酸能发生反应表示怀疑.乙同学实验时向氢氧化钙溶液中应先滴几滴酚酞试液,再滴加适量的稀盐酸,当观察到溶液由红色变为无色时.就可以说明两种物质能发生反应.
(2)当试管中A液体流入锥形瓶B液体中,观察到锥形瓶中先出现气泡,然后又出现了白色沉淀.经过讨论确定,混合液A、B含有的溶质分别是Na2CO3和NaCl,CaCl2和HCl(均写化学式).
分析 (1)氢氧化钙溶液呈碱性,可以使酚酞变红,可以利用该性质来解答该题;
(2)混合液中先有气泡产生,然后又出现了白色沉淀,能够产生气体的是碳酸根和酸,能够生成沉淀的是碳酸根和钙离子,可以据此完成解答;
解答 解:(1)酚酞溶液遇碱性溶液会变红;而在中性或酸性溶液中无色,所以可以用酚酞溶液来判断氢氧化钙和稀盐酸是否反应,若红色褪去;
(2)混合液中先有气泡产生,然后又出现了白色沉淀,结合图中所给的A和B的药品可以知道,A中盐酸和碳酸钠生成氯化钠和水和二氧化碳,B中盐酸和氢氧化钙溶液生成氯化钙和水,而一开始没有沉淀但是有气体产生,说明A中的碳酸钠没有被完全消耗掉,B中所加入的盐酸是过量的,故可以判断A中含有的溶质为碳酸钠和氯化钠,B中含有的溶质为氯化钙和盐酸,
故答案为:(1)溶液由红色变为无色;(2)Na2CO3和NaCl; CaCl2和HCl.
点评 本题主要考查物质的性质和物质间的反应规律,解答此题的关键是只需要对所涉及的各个反应中反应物是否恰好完全反应做出假设,若反应物恰好完全反应,则废液中的溶质只有生成物,若反应结束后反应物仍有剩余,则废液中的溶质除了生成物外还有剩余的反应物.

练习册系列答案
相关题目
14.下列说法中正确的是( )
| A. | 原子核由质子和电子构成 | |
| B. | 化学变化中原子不能再分而分子可以 | |
| C. | 中子不带电,质子带负电,电子带正电 | |
| D. | 相对原子质量=质子数+电子数 |
15.下列选项中属于纯净物的是( )
| A. | 水 | B. | 空气 | C. | 食盐水 | D. | 石灰水 |
16.小明欲测量一石灰石中CaCO3的质量分数,将100g盐酸平均分5次加入到30g石灰石样品中(已知杂质不与盐酸反应也不溶于水,CaCO3与盐酸反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑),得到如下数据.
(1)第2次加入盐酸后,a为20克.
(2)石灰石样品中碳酸钙的质量是20克.
(3)第4次实验后生成的CaCl2溶液的溶质质量分数是多少?(列式计算,结果精确到0.1%)
| 次数 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
| 加入盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
| 剩余固体的质量/g | 25 | a | 15 | 10 | 10 |
(2)石灰石样品中碳酸钙的质量是20克.
(3)第4次实验后生成的CaCl2溶液的溶质质量分数是多少?(列式计算,结果精确到0.1%)
13.某NaOH样品中含有KOH和不容易水和酸的杂质A物质,取样品5.6克,加入100g的稀盐酸溶液,充分反应后共生m克的水,那么根据上述信息下列说法正确的是( )
| A. | 当m=1.8g时,样品中一定含有杂质A,可能含有KOH | |
| B. | 当m=1.8g时,样品中可能含有杂质A或可能含有KOH | |
| C. | 当m=1.8g时,盐酸的质量分数不能低于7.2% | |
| D. | 当m<1.8g时,样品中可能含有杂质A或可能含有KOH |
14. 2015年央视“3•15晚会”曝光山东一些非法炼油厂生产有毒调和汽油,用90号汽油、石脑油、芳泾、甲缩醛等混合而成,其中不少化工原料在国家标准中明令禁止,如甲缩醛会造成汽车漏油、挥发有害气体,污染环境等.甲缩醛分子结构模型如图,下列关于甲缩醛的说法错误的是( )
2015年央视“3•15晚会”曝光山东一些非法炼油厂生产有毒调和汽油,用90号汽油、石脑油、芳泾、甲缩醛等混合而成,其中不少化工原料在国家标准中明令禁止,如甲缩醛会造成汽车漏油、挥发有害气体,污染环境等.甲缩醛分子结构模型如图,下列关于甲缩醛的说法错误的是( )
 2015年央视“3•15晚会”曝光山东一些非法炼油厂生产有毒调和汽油,用90号汽油、石脑油、芳泾、甲缩醛等混合而成,其中不少化工原料在国家标准中明令禁止,如甲缩醛会造成汽车漏油、挥发有害气体,污染环境等.甲缩醛分子结构模型如图,下列关于甲缩醛的说法错误的是( )
2015年央视“3•15晚会”曝光山东一些非法炼油厂生产有毒调和汽油,用90号汽油、石脑油、芳泾、甲缩醛等混合而成,其中不少化工原料在国家标准中明令禁止,如甲缩醛会造成汽车漏油、挥发有害气体,污染环境等.甲缩醛分子结构模型如图,下列关于甲缩醛的说法错误的是( )| A. | 甲缩醛的化学式为C2H4O2 | |
| B. | 甲缩醛由多种物质组成的混合物 | |
| C. | 甲缩醛中碳元素的质量分数最大 | |
| D. | 甲缩醛中碳元素与氧元素质量比为9:8 |

 某兴趣小组根据实验室提供的仪器和药品进行了氧气的制备实验.
某兴趣小组根据实验室提供的仪器和药品进行了氧气的制备实验.
