题目内容
7.氧化铝(Al2O3)、氮化铝(AlN)都是一种重要的无机非金属材料,广泛应用于矿业生产和集成电路生产领域,某化学课题小组的同学在实验室里进行氮化铝的制备并测定其含量的实验.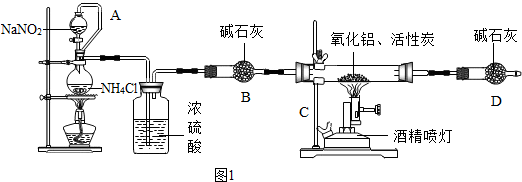
【实验一】制备氮化铝
【资料1】实验室常用饱和亚硝酸钠与氯化铵溶液反应制取纯净的氮气.
有关反应的化学方程式为:
NaNO2+NH4Cl═NaCl+N2↑+2H2O(此反应是放热反应);
Al2O3+3C+N2$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO
试回答:
(1)氮化铝(AlN)中氮元素的化合价是-3.
(2)加入药品前必须进行的一个实验步骤是检验装置气密性,加热片刻后即可移去酒精灯,不需继续加热,其理由是该反应属于放热反应.上述实验装置中存在一些不足,请指出没有尾气处理装置.
(3)在制取氮化铝时由于反应不完全,所得氮化铝产品中的杂质除氧化铝之外,还可能含有C(填化学式).
【实验二】氮化铝含量测定
【资料2】有关氮化铝(AlN)、氧化铝和偏铝酸钠(NaAlO2)的相关反应的化学方程式为:
①AlN+NaOH+H2O═NaAlO2+NH3↑
②Al2O3+2NaOH═2NaAlO2+H2O
③2NaAlO2+CO2+3H2O═2Al(OH)3↓+Na2CO3
【定性分析】
(4)步骤一:小红取C装置中少量固体样品于试管中,加足量氢氧化钠溶液,固体逐渐消失,并得到无色溶液,试管口闻到有刺激性气味的气体生成,则该样品中含有氮化铝.
步骤二:小亮继续在上述无色溶液中通人二氧化碳气体出现白色沉淀,于是他认为样品中一定还存在氧化铝.你认为小亮的结论是否正确,理由是不正确,偏铝酸钠和二氧化碳反应也会生成氢氧化铝沉淀.
【定量测定】.
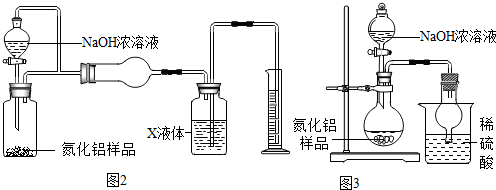
【资料3】氨气的溶解性:极易溶于水,但难溶于有机溶剂四氯化碳(CCl4)和碱性溶液等.
(5)图2装置通过测量氨气的体积从而测定氮化铝的含量.现有如下操作:a.往广口瓶中放入适量的氮化铝样品;b.打开分液漏斗的活塞往锥形瓶中加入过量的浓NaOH溶液;c.检验装置气密性;d.测定收集到X液体的体积.
正确的操作顺序为:cabd(用a、b、c、d字母表示).
(6)图2中X液体可能为B.
A.水 B.四氯化碳 C.氢氧化钠溶液
(7)图3装置则是通过测定吸收氨气的质量从而测定氮化铝的含量.现进行如下操作:取氮化铝样品10克进行实验,若烧杯中物质增重3.4克,则该样品中氮化铝的质量分数是多少?(写出计算过程)
(8)图3所示方案会导致该样品中氮化铝含量测定结果偏低,为提高测定结果的精确度,若不改动装置,可采取的措施是反应结束后,向烧瓶内继续加入足量的氢氧化钠溶液,使装置内残留气体排出,被烧杯中的硫酸充分吸收.
分析 (1)根据化合价代数和为零进行分析;
(2)根据加入药品前必须进行的操作是检查装置的气密性,饱和亚硝酸钠与氯化铵溶液反应放出热量,一氧化碳有毒不能直接排放进行分析;
(3)根据反应物中碳和氧化铝是固体分析解答;
(4)根据偏铝酸钠、二氧化碳和水反应生成氢氧化铝和碳酸钠进行分析;
(5)根据实验时,应该先检验装置的气密性,然后再加入药品进行分析;
(6)根据广口瓶中的试剂X的作用考虑;
(7)根据烧杯中物质增重3.4克,就是生成的氨气的质量,结合化学方程式进行计算;
(8)根据浓硫酸吸收氨气的效果比稀硫酸好进行分析.
解答 解:(1)化合价代数和为零,氮化铝(AlN)中铝元素显示+3价,所以氮元素的化合价是-3;
(2)加入药品前必须进行的操作是检查装置的气密性;饱和亚硝酸钠与氯化铵溶液反应放出热量;一氧化碳有毒不能直接排放,需要尾气处理;
(3)反应物中碳和氧化铝是固体,可能混入产物中,所以氮化铝产品中的杂质除氧化铝之外,还可能含有C;
(4)偏铝酸钠、二氧化碳和水反应生成氢氧化铝和碳酸钠,所以小亮的结论不正确;
(5)实验时,应该先检验装置的气密性,然后再加入药品,所以正确的操作顺序为:cabd;
(6)广口瓶中的试剂X的作用是将氨气与水隔开,因为氨气极易溶于水,要用四氯化碳将氨气与水隔开,水不溶于四氯化碳,故选:B;
(7)烧杯中物质增重3.4克,就是生成的氨气的质量,
设样品中AlN的质量为x
AlN+NaOH+H2O=NaAlO2+NH3↑
41 17
x 3.4g
$\frac{41}{x}$=$\frac{17}{3.4g}$
x=8.2g
所以样品中AlN的质量分数为:$\frac{8.2g}{10g}$×100%=82%;
(8)装置测得的结果偏低是因为生成的氨气会残留在集气瓶内,导致不能被硫酸充分吸收.讲稀硫酸换成浓硫酸一方面没有意义,另一方面还会导致浓硫酸吸收空气中的水蒸气使得测量结果偏大,可采取的措施是:反应结束后,向烧瓶内继续加入足量的氢氧化钠溶液,使装置内残留气体排出,被烧杯中的硫酸充分吸收.
故答案为:(1)-3;
(2)检验装置的气密性;该反应属于放热反应;没有尾气处理装置;
(3)C;
(4)不正确,偏铝酸钠和二氧化碳反应也会生成氢氧化铝沉淀;
(5)cabd;
(6)B;
(7)82%;
(8)反应结束后,向烧瓶内继续加入足量的氢氧化钠溶液,使装置内残留气体排出,被烧杯中的硫酸充分吸收.
点评 解答本题要知道制取气体的一般步骤,知道用排水法测定气体体积的方法,由于氨气极易溶于水,要用植物油将氨气与水分开;知道代入方程式计算的数值只能是质量,必须把体积换算成质量再进行列比例式计算.

| A. | 塑料瓶 | B. | 纯棉衣服 | C. | 陶瓷盘 | D. | 羊毛围巾 |
| 选项 | 实验事实 | 实验结论 |
| A | 某气体能使燃着的木条熄灭 | 该气体一定是二氧化碳 |
| B | 常温下,测得某溶液的pH=10 | 该溶液一定呈碱性 |
| C | 溶液具有均一、稳定的特征 | 均一、稳定的液体一定是溶液 |
| D | 某物质可以导电 | 该物质一定是石墨 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 用水灭火,目的是降低可燃物的着火点 | |
| B. | 在化石燃料中,天然气是比较清洁的燃料 | |
| C. | 有发光、放热现象的一定是燃烧 | |
| D. | 石油、乙醇均是可再生资源 |
| A. | 物理性质 | B. | 制法 | C. | 用途 | D. | 化学性质 |
| A. | 棉、羊毛,塑料等都属于天然有机高分子材料 | |
| B. | 食用加碘食盐和强化铁酱油可补充某些人体必需微量元素 | |
| C. | 用甲醛水溶液浸泡水产品以防止腐烂 | |
| D. | 铁制品表面涂“银粉(铝粉)”防生绣,是由于铝的化学性质比铁稳定 |
 所示的粒子符号为Mg2+.
所示的粒子符号为Mg2+.