题目内容
5.下列结构示意图中,阴离子是( )| A. |  | B. |  | C. |  | D. |  |
分析 熟记规律:阴离子:核电荷数=质子数<核外电子数;原子:核电荷数=核内质子数=核外电子数.阳离子:核内质子数>核外电子数,据此解答.
解答 解:A、核内质子数=核外电子数,为原子,错误;
B、质子数<核外电子数,为阴离子,正确;
C、核内质子数>核外电子数,为阳离子,错误;
D、核内质子数=核外电子数,为原子,错误;
故选B.
点评 了解原子结构示意图与离子结构示意图的区别和联系,根据核内质子数确定元素的类别等知识是解答本题的关键.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案
相关题目
16.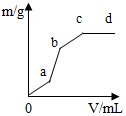 向用盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,产生的沉淀质量m与加入溶液的体积V之间的关系如图所示,关于该曲线的推测正确的是( )
向用盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,产生的沉淀质量m与加入溶液的体积V之间的关系如图所示,关于该曲线的推测正确的是( )
 向用盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,产生的沉淀质量m与加入溶液的体积V之间的关系如图所示,关于该曲线的推测正确的是( )
向用盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,产生的沉淀质量m与加入溶液的体积V之间的关系如图所示,关于该曲线的推测正确的是( )| A. | a-b产生的沉淀为硫酸钡 | |
| B. | a-b产生的沉淀为氢氧化镁 | |
| C. | b-c产生的沉淀为硫酸钡和氢氧化镁 | |
| D. | b-c产生的沉淀为氢氧化镁 |
13.下列试剂瓶标签上的化学式书写错误的是( )
| A. |  | B. |  | C. |  | D. |  |
20.化学可以帮助人类认识改造周围的世界,促进社会发展.
(1)糖类、油脂、蛋白质和维生素都是人类的基本营养物质,下表为某品牌燕麦片标签.
①燕麦片的营养成分中能与水反应生成氨基酸的营养物质是蛋白质;每克营养物质氧化时放出能量最多的是油脂;人体必需的微量元素是锌.
②维生素C易溶于水,在碱性条件下,维生素C易被空气氧化,烧煮时最好加一点食醋.
(2)我们穿的衣服通常是由纤维织成的,常见的纤维有棉花、羊毛、涤纶等.用灼烧法可初步鉴别三种纤维,给三种纤维编号后,分别灼烧产生的气味如下:
则羊毛、棉花的编号分别为③②.
(1)糖类、油脂、蛋白质和维生素都是人类的基本营养物质,下表为某品牌燕麦片标签.
| 每100g含有 营养成分 | 糖类 | 油脂 | 蛋白质 | 维生素C | 钙 | 镁 | 钠 | 锌 |
| 7.6g | 7.8g | 7.4g | 18mg | 201mg | 18.2mg | 30.8mg | 8.1mg |
②维生素C易溶于水,在碱性条件下,维生素C易被空气氧化,烧煮时最好加一点食醋.
(2)我们穿的衣服通常是由纤维织成的,常见的纤维有棉花、羊毛、涤纶等.用灼烧法可初步鉴别三种纤维,给三种纤维编号后,分别灼烧产生的气味如下:
| 纤维编号 | ① | ② | ③ |
| 灼烧时的气味 | 特殊气味 | 烧纸气味 | 烧焦羽毛气味 |
10.下列有关二氧化碳说法正确的是( )
| A. | 二氧化碳可用排水法收集 | |
| B. | 二氧化碳可用燃着的木条鉴定 | |
| C. | 二氧化碳在实验室可以用块状石灰石和浓硫酸反应制备 | |
| D. | 干冰用于制造舞台云雾是因为干冰易升华吸热 |
14.区分下列常见的各组物质时,所用方法错误的是( )
| A. | 氯化钠与硝酸铵固体--加蒸馏水溶解 | |
| B. | 羊毛和棉织品--燃烧闻气味 | |
| C. | 一氧化碳和甲烷--点燃,观察火焰颜色 | |
| D. | 铜片和铁块--观察颜色 |
15.对下列化学用语中“2”所表示的意义理解不正确的是( )
| A. | Fe2+中的“2”表示一个亚铁离子带两个单位正电荷 | |
| B. | 2H中的“2”表示两个氢元素 | |
| C. | $\stackrel{+2}{Mg}$O中的“2”表示镁元素的化合价为+2 | |
| D. | N2中的“2”表示一个氮气分子中含有两个氮原子 |
 如图是某同学设计的趣味实验装置,其气密性良好.
如图是某同学设计的趣味实验装置,其气密性良好.