题目内容
酸、碱、盐知识是初化学的重要组成部分,小亮同学针对本部分内容进行了一系列的探究学习.
(1)溶解性表是学习化学的重要工具.小亮同学研究了“部分酸、碱、盐在20℃时的溶解性”(如表),认为其中的 (填物质化学式,下同)是一种微溶于水的盐, 是一种可溶于水的碱.
(2)如图是稀硫酸和氢氧化钠溶液反应的微观示意图,从粒子角度分析,该反应发生的实质是 .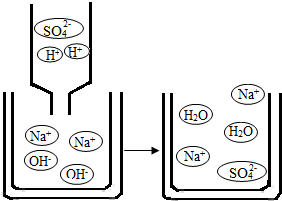
(3)硫酸是中学常见的酸.稀硫酸是用浓硫酸稀释而得到的.浓硫酸的稀释方法是 .
(4)某同学在学习酸碱的化学性质时构建如图知识网络,A、B、C、D是不同类别的无机化合物,“-”表示物质在一定条件下可以发生化学反应请回答:①写出图中一个中和反应的化学方程式 ;
②物质C应具备的条件是 .

(5)某化工厂排出的废水中含有一定量的氢氧化钾.取20g废水于锥形瓶中,逐渐加入2%的稀盐酸,至恰好完全反应时,消耗稀盐酸7.3g,求废水中氢氧化钾的质量分数?
| OH- | NO
|
Cl- | C
|
SO
| |||||||
| H+ | 溶、挥 | 溶、挥 | 溶、挥 | 溶 | |||||||
| Ca2+ | 微 | 溶 | 溶 | 不 | 微 | ||||||
| Ba2+ | 溶 | 溶 | 溶 | 不 | 不 | ||||||
| Cu2+ | 不 | 溶 | 溶 | 不 | 溶 |
(2)如图是稀硫酸和氢氧化钠溶液反应的微观示意图,从粒子角度分析,该反应发生的实质是

(3)硫酸是中学常见的酸.稀硫酸是用浓硫酸稀释而得到的.浓硫酸的稀释方法是
(4)某同学在学习酸碱的化学性质时构建如图知识网络,A、B、C、D是不同类别的无机化合物,“-”表示物质在一定条件下可以发生化学反应请回答:①写出图中一个中和反应的化学方程式
②物质C应具备的条件是

(5)某化工厂排出的废水中含有一定量的氢氧化钾.取20g废水于锥形瓶中,逐渐加入2%的稀盐酸,至恰好完全反应时,消耗稀盐酸7.3g,求废水中氢氧化钾的质量分数?
考点:酸碱盐的溶解性,浓硫酸的性质及浓硫酸的稀释,有关溶质质量分数的简单计算,酸的化学性质,碱的化学性质,中和反应及其应用,根据化学反应方程式的计算
专题:溶质质量分数与化学方程式相结合的计算,常见的酸 酸的通性,常见的碱 碱的通性,常见的盐 化学肥料
分析:根据提供的信息进行分析,根据表格可以确定物质的溶解性;结合图示判断酸和碱反应的实质;结合浓硫酸的稀释方法进行解答;根据酸和碱的性质确定B和C,然后进行解答;根据反应的化学方程式进行计算即可.
解答:解:(1)根据表格可以看出,硫酸钙是一种微溶于水的盐,氢氧化钙是一种微溶于水的碱,故填:CaSO4,Ca(OH)2;
(2)据图可以看出,硫酸和氢氧化钠反应的实质是酸中的氢离子和碱中的氢氧根离子结合产生了水分子,故填:H++OH-=H2O;
(3)稀释浓硫酸时要将浓硫酸沿器壁慢慢注入水中,并用玻璃棒不断的搅拌,故填:将浓硫酸沿器壁慢慢注入水中,并用玻璃棒不断的搅拌;
(4)①硫酸能和氢氧化钙发生中和反应生成硫酸钙和水,故填:H2SO4+Ca(OH)2═CaSO4+2H2O;
②C既能和盐酸反应,也能和氢氧化钙反应,则C属于盐,并且必须是可溶性盐,与酸或碱反应使能生成沉淀、气体或水,故填:属于盐,并且必须是可溶性盐,与酸或碱反应使能生成沉淀、气体或水;
(5)设废水中氢氧化钾的质量为x
HCl+KOH═KCl+H2O
36.5 56
7.3g×2% x
=
x=0.224g
废水中氢氧化钾的质量分数为:
×100%=1.12%
答:废水中氢氧化钾的质量分数为1.12%.
(2)据图可以看出,硫酸和氢氧化钠反应的实质是酸中的氢离子和碱中的氢氧根离子结合产生了水分子,故填:H++OH-=H2O;
(3)稀释浓硫酸时要将浓硫酸沿器壁慢慢注入水中,并用玻璃棒不断的搅拌,故填:将浓硫酸沿器壁慢慢注入水中,并用玻璃棒不断的搅拌;
(4)①硫酸能和氢氧化钙发生中和反应生成硫酸钙和水,故填:H2SO4+Ca(OH)2═CaSO4+2H2O;
②C既能和盐酸反应,也能和氢氧化钙反应,则C属于盐,并且必须是可溶性盐,与酸或碱反应使能生成沉淀、气体或水,故填:属于盐,并且必须是可溶性盐,与酸或碱反应使能生成沉淀、气体或水;
(5)设废水中氢氧化钾的质量为x
HCl+KOH═KCl+H2O
36.5 56
7.3g×2% x
| 36.5 |
| 7.3g×2% |
| 56 |
| x |
废水中氢氧化钾的质量分数为:
| 0.224g |
| 20g |
答:废水中氢氧化钾的质量分数为1.12%.
点评:本题考查了化学反应的实质以及根据化学反应的有关计算,完成此题,可以依据已有的知识进行.

练习册系列答案
相关题目
下列关于钢的说法不正确的是( )
| A、钢是纯净物 |
| B、钢是铁合金 |
| C、钢的含碳量低于生铁 |
| D、钢的性能优于生铁 |
活动性较强的非金属可把活动性较弱的非金属从其盐溶液中置换出来.Br2、I2、Cl2及其化合物间有如下关系:Br2+2NaI═2NaBr+I2;Cl2+2NaBr═2NaCl+Br2.因此,非金属单质Br2、I2、Cl2的活动性由强到弱的顺序为( )
| A、I2、Cl2、Br2 |
| B、Br2、Cl2、I2 |
| C、Cl2、I2、Br2 |
| D、Cl2、Br2、I2 |



