题目内容
1.某化学兴趣小组同学对木炭还原氧化铜的实验进行了一系列的探究及分析.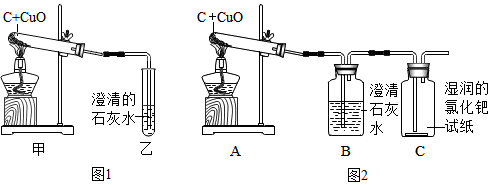
(1)点燃酒精灯,数分钟后发现图1甲装置的试管中出现的现象是黑色固体变成红色固体.乙试管中发生反应的化学
方程式为:Ca(OH)2+CO2═CaCO3↓+H2O.
实验完毕,应先将导管移离液面,再熄灭酒精灯,其原因防止液体倒流炸裂试管;并用弹簧夹夹紧橡皮管,其原因又是防止氧气进入试管把铜氧化.
(2)C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑,C将CuO还原成Cu,故C作还原剂.
①先分析,再归纳:反应前后,还原剂化合价的变化规律是升高.
②根据你所得的规律,判断Zn+H2SO4═ZnSO4+H2↑,还原剂是Zn.
(3)联想到单质碳的其他化学性质,小组同学认为在该实验中还可能会有CO产生.
【查阅资料】CO气体能使湿润的黄色氯化钯试纸变蓝色
【实验装置】如图2所示
【现象结论】C装置中湿润的黄色氯化钯试纸变蓝色,证明同学们判断正确.
【实验反思】①考虑到有CO生成,上述实验装置有一个不足之处是没有处理尾气.
②李洋同学对CO产生的原因进行了分析:
原因一:C+CuO在高温条件下直接发生反出产生CO;
原因二:反应C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑中的生成物,和反应物又发生了新的反应,产生了CO.
请你从选择其中一个原因,用化学方程式表示存在此原因的反应原理CuO+C$\frac{\underline{\;高温\;}}{\;}$Cu+CO↑,或CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO.
(4)小组同学对A装置反应后试管内的残留固体成分作了如下的猜想:
猜想I:只有铜
猜想Ⅱ:除铜外,还含有木炭
猜想Ⅲ:除铜外,还含有氧化铜
猜想Ⅳ:除铜外,还含有木炭和氧化铜
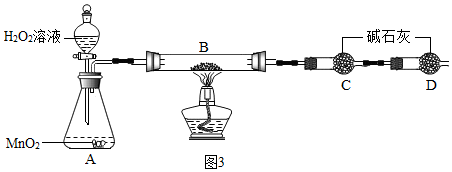
若猜想Ⅱ成立.小组同学想测量该残留固体中铜的质量分数,他们称取了10g固体样品,采用图示装置(气密性良好,图中铁架台等仪器已略去)准备实验.
(已知:碱石灰是固体氢氧化钠和生石灰混合物,可用吸收水和CO2)
【实验装置】如图3所示
【实验步骤】
a.在A、B、C、D四个装置中放入相应的物质,并称量C装置的质量为20g
b.先连接A、B装置,打开分液漏斗活塞,慢慢滴加H2O2溶液
c.稍后再连接C、D,加热B装置
d.当药品充分反应后,停止加热,继续加入H2O2溶液
e.关闭分液漏斗活塞,冷却到室温,再次称量C的质量为22.2g
【数据计算】求得原混合物中铜的质量分数为94%.请在如图4所示框中简要写出计算过程.
【问题讨论】
①D装置的作用是防止空气中的水蒸气和二氧化碳进入C中.
②在实验步骤b、c中,先连接A、B装置加入H2O2溶液,后连接C、D加热B装置的目的是利用氧气把装置中的空气排出,防止空气中的水蒸气和二氧化碳对C装置产生干扰.
③在实验步骤d中,停止加热,继续加入H2O2溶液目的是利用产生的氧气把反应生成的二氧化碳全部排入C中.
④实验完成后,教师评议说:按上述实验设计,即使B装置中反应完全,C装置吸收完全,也不会得出正确结果.经讨论,有同学提出在A、B之间(填两个装置的代号)加入一装置,就能得到较准确结果,该装置的作用是吸收水蒸气,请你判断原测得结果将偏小 (填“偏大”、“不变”、“偏小”).
分析 (1)加热条件下,氧化铜和碳反应生成铜和二氧化碳,二氧化碳能使澄清石灰水变浑浊;
为了防止液体倒吸,实验完毕后,应先将导管移离液面,再熄灭酒精灯;
为了防止高温条件下铜被空气中的氧气氧化,应该用弹簧夹夹紧橡皮管;
(2)单质中元素的化合价为0,化合物中元素化合价代数和为0;
(3)一氧化碳有毒,扩散都空气中会污染环境;
高温条件下,氧化铜和碳反应生成铜和一氧化碳,二氧化碳和碳反应生成一氧化碳;
(4)反应过程中,氧化铜和碳可能恰好完全反应,也可能氧化铜或碳过量,也可能氧化铜和碳都没有完全反应;
碳和氧气反应生成二氧化碳,根据反应的化学方程式和提供的数据可以进行相关方面的计算;
碱石灰能够吸收水蒸气和二氧化碳;
浓硫酸能够吸收水蒸气.
解答 解:(1)点燃酒精灯,数分钟后发现图1甲装置的试管中出现的现象是黑色固体变成红色固体;
乙试管中发生反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O;
实验完毕,应先将导管移离液面,再熄灭酒精灯,能够防止液体倒流炸裂试管;
用弹簧夹夹紧橡皮管,能够防止氧气进入试管把铜氧化.
故填:黑色固体变成红色固体; Ca(OH)2+CO2═CaCO3↓+H2O;防止液体倒流炸裂试管;防止氧气进入试管把铜氧化.
(2)①反应前后,还原剂碳的化合价由0变成+4,变化规律是化合价升高.
故填:升高.
②Zn+H2SO4═ZnSO4+H2↑中,锌的化合价由0变成+2,因此还原剂是Zn.
故填:Zn.
(3)【实验反思】
①考虑到有CO生成,上述实验装置有一个不足之处是没有处理尾气.
故填:没有处理尾气.
②高温条件下,氧化铜和碳反应生成铜和一氧化碳,二氧化碳和碳反应生成一氧化碳,反应的化学方程式为:CuO+C$\frac{\underline{\;高温\;}}{\;}$Cu+CO↑,CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO.
故填:CuO+C$\frac{\underline{\;高温\;}}{\;}$Cu+CO↑,或CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO.
(4)猜想I:只有铜
猜想Ⅱ:除铜外,还含有木炭
猜想Ⅲ:除铜外,还含有氧化铜
猜想Ⅳ:除铜外,还含有木炭和氧化铜
故填:除铜外,还含有氧化铜;除铜外,还含有木炭和氧化铜.
【数据计算】
设碳的质量为x,
反应生成二氧化碳质量为:22.2g-20g=2.2g,
C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2,
12 44
x 2.2g
$\frac{12}{x}$=$\frac{44}{2.2g}$,
x=0.6g,
原混合物中铜的质量分数为:$\frac{10g-0.6g}{10g}$×100%=94%,
故填:94%.
【问题讨论】
①D装置的作用是防止空气中的水蒸气和二氧化碳进入C中.
故填:防止空气中的水蒸气和二氧化碳进入C中.
②在实验步骤b、c中,先连接A、B装置加入H2O2溶液,后连接C、D加热B装置的目的是利用氧气把装置中的空气排出,防止空气中的水蒸气和二氧化碳对C装置产生干扰.
故填:利用氧气把装置中的空气排出,防止空气中的水蒸气和二氧化碳对C装置产生干扰.
③在实验步骤d中,停止加热,继续加入H2O2溶液目的是利用产生的氧气把反应生成的二氧化碳全部排入C中.
故填:利用产生的氧气把反应生成的二氧化碳全部排入C中.
④实验完成后,教师评议说:按上述实验设计,即使B装置中反应完全,C装置吸收完全,也不会得出正确结果,原因是生成的氧气中带有水蒸气,经讨论,有同学提出在A、B之间加入一装置,就能得到较准确结果,该装置的作用是吸收水蒸气;
因为氧气中带有水蒸气,会导致测定的二氧化碳质量偏大,从而导致计算的铜质量偏小,进一步导致原测得结果偏小.
故填:A、B;吸收水蒸气;偏小.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

| A. | 煤炭 | B. | 地热能 | C. | 石油 | D. | 甲烷 |
| 第1次 | 第2次 | 第3次 | 第4次 | |
| 加人稀硫酸质量/g | 50 | 50 | 50 | 50 |
| 剩余固体质量/g | 43.5 | 37.0 | 33.75 | 33.75 |
(2)当加入稀硫酸的质量为125g时,反应恰好完成.
(3)计算所用稀硫酸的浓度(写出计算过程).

(1)图中①、③发生了置换反应,②发生了化合反应.写出②和③的化学反应方程式:
②Si+2Cl2$\frac{\underline{\;高温\;}}{\;}$SiCl4;③SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$Si+4HCl.
(2)完成一种表示置换反应的通式:单质(I)+化合物(I)=单质(Ⅱ)+化合物(Ⅱ).
根据已学知识填表:
| 单质(I) | 单质(Ⅱ) | 相应的置换反应的化学方程式(各举一例) | |
| A | 金属 | 非金属 | |
| B | 金属(I) | 金属(Ⅱ) | |
| C | 非金属 | 金属 | |
| D | SiO2+2C$\frac{\underline{\;高温、电炉\;}}{\;}$Si+2CO↑ |
查阅资料:CO2+Zn $\frac{\underline{\;\;△\;\;}}{\;}$CO+ZnO; FeCl3溶液遇KSCN溶液变红.
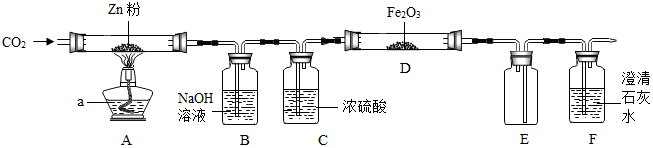
请回答下列问题:
(1)装置B的作用是吸收二氧化碳,发生的反应2NaOH+CO2═Na2CO3+H2O(化学方程式);某同学建议F后面应加一盏酒精灯,目的是把一氧化碳转化成二氧化碳.
(2)将研究小组分为两组,按如图装置进行对比实验:甲组用酒精灯、乙组用酒精喷灯对装置D进行加热,其产物均为黑色粉末(经检测为纯净物).两组分别用产物进行以下实验:
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入盐酸 | 溶解,无气泡,溶液呈浅黄绿色(含两种金属离子) | 溶解,有气泡,溶液呈浅绿色 |
| 2 | 取步骤1所得溶液,滴加KSCN溶液 | 变红 | 无现象 |
(3)通过该对比实验结果,你可以归纳出温度不同,一氧化碳还原氧化铁的生成物不同结论.
 物质之间发生化学反应时常伴随有明显的现象,但有些化学反应却观察不到明显的现象.某班同学为证明NaOH能与稀盐酸发生中和反应,从不同角度设计了如下实验方案,并进行实验.
物质之间发生化学反应时常伴随有明显的现象,但有些化学反应却观察不到明显的现象.某班同学为证明NaOH能与稀盐酸发生中和反应,从不同角度设计了如下实验方案,并进行实验.