题目内容
19.在Cu(NO3)2、AgNO3、Zn(NO3)2的混合溶液中,加入一定量的铁粉,充分反应.(1)若铁粉过量,则反应后溶液中所含的金属阳离子是Fe2+、Zn2+.
(2)若铁粉不足,将反应后的混合物过滤,则固体物质中一定含有Ag.
分析 根据四种金属的活动性强弱关系:锌>铁>铜>银,分析向混合溶液中加入铁粉后所发生的反应,进而判断反应后溶液或固体的成分;并写出反应的化学方程式.
解答 解:(1)铁粉过量,说明混合溶液中的硝酸铜和硝酸银全部与铁粉发生反应,反应使铁粉变成硝酸亚铁,因此反应后溶液中只含有反应生成的硝酸亚铁和不反应的硝酸锌;溶液中的金属离子为Fe2+、Zn2+;
故答案为:Fe2+、Zn2+;
(2)铁粉不足,因铁粉会先和混合溶液中有硝酸银发生反应,所以滤出的固体中一定含有银;由于铁粉不足,不能判断是否与硝酸铜发生反应,也就无法判断固体中是否含铜;
故填:Ag.
点评 金属与盐的混合溶液反应时,是按金属的活动性由弱到强集依次进行的,即先置换出活动性最弱的金属,最后置换出活动性强的金属.

练习册系列答案
相关题目
2.下列物质的用途主要是由其化学性质决定的是( )
| A. |  活性炭净化空气 | B. |  铜丝制导线 | C. |  生铁制炊具 | D. |  生石灰催熟芒果 |
10.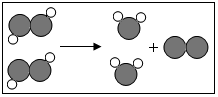 如图为某反应的微观示意图,不同的球代表不同元素的原子.下列说法错误的是( )
如图为某反应的微观示意图,不同的球代表不同元素的原子.下列说法错误的是( )
 如图为某反应的微观示意图,不同的球代表不同元素的原子.下列说法错误的是( )
如图为某反应的微观示意图,不同的球代表不同元素的原子.下列说法错误的是( )| A. | 该反应的反应物可能属于氧化物 | |
| B. | 不考虑反应条件时,该图示可以表示双氧水制取氧气的反应 | |
| C. | 该反应的反应类型为分解反应 | |
| D. | 该反应生成物都属于化合物 |
11.下列关于水的说法中,正确的是( )
| A. | 地球上水储量丰富,而且大部分是可供利用的淡水 | |
| B. | 水的生成和分解的实验,都可说明水是由氧分子组成的 | |
| C. | 在水电解反应中,氢原子和氧原子都没有发生变化 | |
| D. | 在水电解实验中,与电源正极相连的玻璃管内得到的气体能在空气中燃烧 |
8.下列化学用语表达正确的是( )
| A. | 60个碳原子--C60 | B. | 氧化铁--Fe2O3 | ||
| C. | 正二价的锌元素--Zn2+ | D. | 两个一氧化碳分子--2Co |
9.某密闭容器内有X、Y、Z、W四种物质,在一定条件下充分反应,测得反应前后各物质的质量如表:
下列说法正确的是( )
| 物质 | X | Y | Z | W |
| 反应前质量/g | 4 | 1 | 10 | 2 |
| 反应后质量/g | 待测 | 5 | 4 | 8 |
| A. | 反应后X的质量为5g | B. | Z与W的相对分子质量比一定是1:1 | ||
| C. | 该反应的反应物只有Z | D. | 参加反应的X与Z的质量比是2:3 |
 通过一年的化学学习,你已经掌握了实验室制取气体的有关规律,如图是老师提供的一些实验装置.请结合如图回答问题:
通过一年的化学学习,你已经掌握了实验室制取气体的有关规律,如图是老师提供的一些实验装置.请结合如图回答问题: