题目内容
11.臭氧主要分布在距地面10-15km的高空,它能吸收大部分紫外线,保护地球生物,臭氧的化学式为( )| A. | 2O | B. | O2 | C. | 03 | D. | 30 |
分析 根据气态非金属单质,在元素符号的右下角写上表示分子中所含原子数的数字,进行分析判断.
解答 解:A、臭氧属于气态非金属单质,在元素符号的右下角写上表示分子中所含原子数的数字,其化学式为03,2O可表示2个氧原子,故选项错误.
B、臭氧属于气态非金属单质,在元素符号的右下角写上表示分子中所含原子数的数字,其化学式为03,O2可表示氧气,故选项错误.
C、臭氧属于气态非金属单质,在元素符号的右下角写上表示分子中所含原子数的数字,其化学式为03,故选项正确.
D、臭氧属于气态非金属单质,在元素符号的右下角写上表示分子中所含原子数的数字,其化学式为03,3O可表示3个氧原子,故选项错误.
故选:C.
点评 本题难度不大,掌握单质化学式的书写方法并能灵活运用是正确解答本题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.金属镍(Ni)与物质X的溶液发生反应的化学方程式为:Ni+X═Cu+NiSO4,则下列说法错误的是( )
| A. | Ni的化合价由0价变为+2价 | B. | X的化学式为CuSO4 | ||
| C. | 该反应前后原子种类没有发生改变 | D. | Cu的金属活动性比Ni强 |
2.为了对氯化钾样品(含少量KNO3)进行分析,甲、乙、丙三位同学分别进行实验,他们实验数据如表,请仔细观察和分析数据回答问题:
(1)三位同学中,哪一位同学所用氯化钾和硝酸银刚好完全反应乙(填编号)
(2)样品中氯化钾的质量分数是多少?
(3)三位同学分别把反应后的溶液过滤(操作中的损失可忽略不计),哪一位同学所得的溶液是只含有一种溶质的溶液?此溶液中溶质的质量分数是多少?
| 甲 | 乙 | 丙 | |
| 所取固体样品的质量/g | 20 | 10 | 10 |
| 加入AgNO3溶液的质量/g | 100 | 100 | 150 |
| 反应后所得沉淀的质量/g | 14.35 | 14.35 | 14.35 |
(2)样品中氯化钾的质量分数是多少?
(3)三位同学分别把反应后的溶液过滤(操作中的损失可忽略不计),哪一位同学所得的溶液是只含有一种溶质的溶液?此溶液中溶质的质量分数是多少?
19.大理石广泛存在于自然界,某种大理石除主要成分CaC03外,还有少量的硫化钙.甲和乙两位同学用这种大理石和稀盐酸反应分别并展以下探究.
【查阅资料】资料一:在常温下,测的浓度均为a%的下列5种溶液的pH大小情况:
A.H2S04+2NaHC03═Na2S04+2H20+2C02↑ B.2HCl+CaS═CaCl2+H2S↑
C.C02+H20+Ca(C10)2═CaC03↓+2HClO D.H2S+CuS04═H2S04+CuS↓
资料二:常见干燥剂有①浓硫酸②无水氯化钙③碱石灰④生石灰
【实验探究】同学为了得到纯净的二氧化碳,设计了如下装置,请你分析:
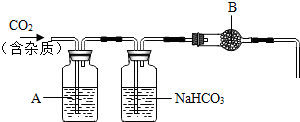
(1)制备的C02气体中,可能含有的杂质是HCl、H2S、和水蒸气;
(2)上述装置中,A是硫酸铜溶液,饱和NaHCO3溶液可以吸收HCl、H2S等酸性气体;
(3)上述装置中,B物质可能是无水氯化钙(写名称);
(4)用这个实验得到的气体测定C02的相对分子质量,如果B物质失效,测定结果偏高(填“偏高”、“偏低”或“不受影响”);
(5)乙同学为了计算这种大理石中含碳酸钙质量分数,进行了如下定量实验:
乙同学通过分析计算,得出结论:该实验中生成的二氧化碳的质量是4.4g,大理石样品纯度为83.3%.请你评价他的结论是否正确错误(填“正确”或“错误”,并简述理由)大理石中含有硫化物,硫化物与盐酸反应会生成硫化氢气体逸出,把生成的气体全部作为二氧化碳,使碳酸钙质量偏大,造成质量分数偏大.
【查阅资料】资料一:在常温下,测的浓度均为a%的下列5种溶液的pH大小情况:
| 溶质 | H2S04 | HCl | H2S | H2C03 | HClO |
| PH | 小→大 | ||||
C.C02+H20+Ca(C10)2═CaC03↓+2HClO D.H2S+CuS04═H2S04+CuS↓
资料二:常见干燥剂有①浓硫酸②无水氯化钙③碱石灰④生石灰
【实验探究】同学为了得到纯净的二氧化碳,设计了如下装置,请你分析:

(1)制备的C02气体中,可能含有的杂质是HCl、H2S、和水蒸气;
(2)上述装置中,A是硫酸铜溶液,饱和NaHCO3溶液可以吸收HCl、H2S等酸性气体;
(3)上述装置中,B物质可能是无水氯化钙(写名称);
(4)用这个实验得到的气体测定C02的相对分子质量,如果B物质失效,测定结果偏高(填“偏高”、“偏低”或“不受影响”);
(5)乙同学为了计算这种大理石中含碳酸钙质量分数,进行了如下定量实验:
| 实验步骤 | I.将适量盐酸加入烧杯中并称重 | Ⅱ.称取少量大理石样品加入烧杯中,使之与过量稀盐酸反应 | Ⅲ.待反应完全后,称重 |
| 实验图示 | 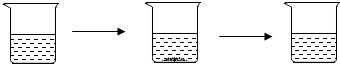 | ||
| 实验数据 | 烧杯和盐酸的质量为100.0g | 大理石样品的质量为12.0g | 烧杯和其中混合物的质量为107.6g |
16.我们知道,湿衣服在阳光下比在阴凉处干的快,对此现象的解释最合理的是( )
| A. | 分子的运动速率随温度的升高而加快 | |
| B. | 分子在不停地做无规则运动 | |
| C. | 分子的质量和体积都很小 | |
| D. | 分子之间有间隔 |
20.下来有关环境问题的叙述正确的是( )
| A. | 为解决“白色污染”问题,可将废弃塑料焚烧处理 | |
| B. | 汽车使用乙醇汽油可减缓温室效应 | |
| C. | 通过秸秆综合利用,杜绝露天焚烧,来降低空气中PM2.5的含量 | |
| D. | 化工厂通过加高烟囱来排放废弃,以防止形成酸雨 |
