题目内容
19.澄清石灰水通入二氧化碳先发生的反应是:CO2+Ca(OH)2═CaCO3↓+H2O.若通入过量发生第二个反应:CO2+CaCO3+H2O═Ca(HCO3)2,向含有7.4g氢氧化钙的澄清石灰水中通入一定量的二氧化碳,得到4g白色沉淀,则通入二氧化碳的质量是多少?分析 根据二氧化碳和氢氧化钙反应生成碳酸钙白色沉淀和水;二氧化碳过量,二氧化碳又会与碳酸钙、水反应生成易溶的碳酸氢钙,所以存在两种情况,二氧化碳的量比较少,与氢氧化钙反应生成4g碳酸钙,或二氧化碳比较多,与所有的氢氧化钙反应生成的碳酸钙沉淀又有一部分与二氧化碳反应生成碳酸氢钙,最后剩余4g碳酸钙未反应.
解答 解:分两种情况讨论:
(1)二氧化碳的量比较少,
设二氧化碳的质量为x
Ca(OH)2+CO2═CaCO3↓+H2O
44 100
x 4g
即$\frac{44}{x}=\frac{100}{4g}$,
x=1.76g;
(2)二氧化碳过量
和7.4g氢氧化钙反应的二氧化碳质量为y,生成沉淀为z
Ca(OH)2+CO2═CaCO3↓+H2O
74 44 100
7.4g y z
$\frac{74}{7.4g}=\frac{44}{y}$
y=4.4g
$\frac{74}{7.4g}=\frac{100}{z}$
z=10g
然后有10g-4g=6g碳酸钙和过量的二氧化碳反应,消耗二氧化碳的质量为w
CO2+CaCO3+H2O═Ca(HCO3)2,
44 100
w 6g
$\frac{44}{w}=\frac{100}{6g}$
w=2.64g
所以通入二氧化碳的质量为4.4g+2.64g=7.04g
答:通入二氧化碳的质量为1.76g或7.04g.
点评 澄清石灰水中通入二氧化碳会变浑浊,继续通二氧化碳又会变澄清,就是发生了上述反应.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.归纳与总结是学好化学的重要方法.下列对所学知识的整理,正确的是( )
| A. | pH:正常雨水<酸雨 | |
| B. | 等质量的木炭燃烧放出的热量:完全燃烧>不完全燃烧 | |
| C. | 含碳量:生铁<钢 | |
| D. | 任何原子中:核内质子数=核外电子数 |
10.如表是元素周期表的一部分,请回答相关问题.
(1)M+与Ne核外电子排布相同,则M元素的名称为Na;
(2)第三周期中具有稳定结构的原子的质子数是18.
| 第一周期 | 1H | 2He | ||||||
| 第二周期 | 3Li | 4Be | 5B | 6C | 7N | 8O | 9F | l0Ne |
| 第三周期 | 11Na | 12Mg | 13A1 | 14Si | 15P | 16S | 17C1 | l8Ar |
(2)第三周期中具有稳定结构的原子的质子数是18.
7.将铁粉加人到一定量的硝酸银、硝酸铜及硝酸锌的混合溶液中,待充分反应后过滤.向滤渣中加人稀盐酸,没有气体产生,则滤液中的溶质是( )
| A. | 只有硝酸锌 | B. | -定有硝酸锌和硝酸铁 | ||
| C. | 若没有硝酸铜,则一定没有硝酸银 | D. | -定没有硝酸银 |
11.甲醛是装修材料中常见的污染物,其分子结构如图所示,下列说法正确的是( )

| A. | 甲醛由碳、氢、氧三种元素组成 | |
| B. | 甲醛的相对分子质量为30g | |
| C. | 甲醛由一个碳原子、2个氢原子和1个氧原子构成 | |
| D. | 甲醛中碳、氢、氧三种元素的质量比为1:2:1 |
9.甲和乙在一定条件下反应生成丙和丁,结合微观示意图分析,结论正确的是( )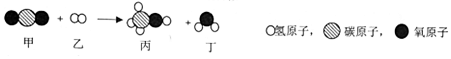

| A. | 反应过程中只有丁属于氧化物 | |
| B. | 发生反应的甲和乙的质量比为22:1 | |
| C. | 可用于减少温室气体的排放 | |
| D. | 反应前后,原子的种数不变,数目改变 |
 如图所示,往水电解器中加入96g蒸馏水和2g Na2SO4(Na2SO4不参与反应,仅起增加水的导电性的作用)组成的混合物,然后进行电解,当负极得到2g气体时,停止实验(所需相对原子质量:H-1、O-16).计算:
如图所示,往水电解器中加入96g蒸馏水和2g Na2SO4(Na2SO4不参与反应,仅起增加水的导电性的作用)组成的混合物,然后进行电解,当负极得到2g气体时,停止实验(所需相对原子质量:H-1、O-16).计算:
 如图是A、B、C三种固体物质的溶解度曲线,请回答下列问题:
如图是A、B、C三种固体物质的溶解度曲线,请回答下列问题: