题目内容
7.在下面关系图中,甲、乙、丙、丁是初中化学中常见的单质,其中甲和乙是气体,丁是地壳中含量第二位的金属,B是光合作用必要的原料,F是能使紫色石蕊试液变蓝的气体.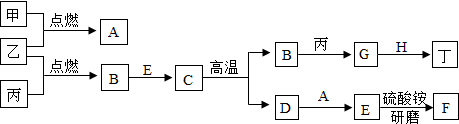
(1)写出化学式:丙C,AH2O;
(2)与A物质组成元素相同的物质是H2O2(填写化学式);
(3)写出下列反应的化学方程式:
B→C:Ca(OH)2+CO2═CaCO3↓+H2O,该反应在实验室中常用于检验二氧化碳气体;
E→F:(NH4)2SO4+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaSO4+2H2O+2NH3↑,该反应决定了在施用硫酸铵化肥时应注意不能和显碱性的物质混用.
分析 氢气燃烧生成水,碳燃烧生成二氧化碳,二氧化碳能和氢氧化钙反应生成碳酸钙和水,高温条件下,碳酸钙分解生成氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙,加热条件下,氢氧化钙和硫酸铵反应生成硫酸钙、水和氨气,高温条件下,二氧化碳和碳反应生成一氧化碳,高温条件下,一氧化碳和铁的氧化物反应生成铁,铁是地壳中含量第二位的金属.
解答 解:氢气燃烧生成水,碳燃烧生成二氧化碳,二氧化碳能和氢氧化钙反应生成碳酸钙和水,高温条件下,碳酸钙分解生成氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙,加热条件下,氢氧化钙和硫酸铵反应生成硫酸钙、水和氨气,高温条件下,二氧化碳和碳反应生成一氧化碳,高温条件下,一氧化碳和铁的氧化物反应生成铁,铁是地壳中含量第二位的金属,因此甲、乙、丙、丁、A、B、C、D、E、F、G、H分别是氢气、氧气、碳、铁、水、二氧化碳、碳酸钙、氧化钙、氢氧化钙、氨气、一氧化碳、铁的氧化物;
(1)丙是C,A是H2O.
故填:C;H2O.
(2)与水组成元素相同的物质是H2O2.
故填:H2O2.
(3)氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O,该反应在实验室中常用于检验二氧化碳气体;
氢氧化钙和硫酸铵反应生成硫酸钙、水和氨气,反应的化学方程式为:(NH4)2SO4+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaSO4+2H2O+2NH3↑,该反应决定了在施用硫酸铵化肥时应注意不能和显碱性的物质混用.
故填:Ca(OH)2+CO2═CaCO3↓+H2O;检验二氧化碳气体;(NH4)2SO4+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaSO4+2H2O+2NH3↑;不能和显碱性的物质混用.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

| A. | 水 | B. | 食盐 | C. | 食醋 | D. | 纯碱 |
【查阅资料】①CO2通入NaOH溶液时极易因CO2过量而产生NaHCO3,且无明显现象.
②NaHCO3溶液煮沸时不会发生分解.
③NaHCO3+NaOH=Na2CO3+H2O
④Ca(HCO3)2可溶于水
【制取步骤】①量取两份50mL相同浓度的NaOH溶液备用;
②用一份50mL NaOH 溶液吸收过量的CO2气体,至CO2气体不再溶解;
③小心煮沸②溶液1~2分钟;
④在得到的③的溶液中加入另一份50mL NaOH 溶液,使其充分混合即得.
【实验探究】为了检验制得的溶液是否为纯净的Na2CO3溶液,请你与小刘同学一起完成
下列实验探究:
| 实验步骤 | 实验现象 | 实验结论 | |
| 取少量制得的溶液于试管中,加入过量的氯化钙溶液 | 产生白色沉淀 | 原来制得的溶液中含有Na2CO3 | |
| 将上步实验所得混合物进行过滤,将滤液分成两份 | 取其中一份加入足量的稀盐酸 | 无气泡产生 | 原来制得的溶液中不含NaHCO3 |
| 取另一份加入MgCl2溶液 | 不产生沉淀 | 原来制得的溶液中不含NaOH | |
【评价与反思】有人认为实验步骤③④的顺序对调,即先混合,再煮沸,更合理.有人说不能.请说明不能对调的理由:在煮沸之前溶液中含有未参与反应的二氧化碳气体,如果先混合,则氢氧化钠溶液会和溶液中的二氧化碳继续反应,导致制备的碳酸钠不纯净.
| A. | 煤和石油的燃烧 | B. | 建筑工地的噪声 | C. | 燃放烟花爆竹 | D. | 植物的光合作用 |



 代表氧原子,用“o”代表氢原子,则表示此反应的化学方程式是:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑;其基本反应类型是分解反应.
代表氧原子,用“o”代表氢原子,则表示此反应的化学方程式是:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑;其基本反应类型是分解反应.