题目内容
14. 雨、雪在形成和降落过程中吸收、溶解了空气中SO2及氮氧化物等物质,形成了PH小于5.6的降水称为酸雨,请回答下列有关酸雨的问题:
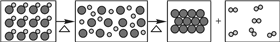
雨、雪在形成和降落过程中吸收、溶解了空气中SO2及氮氧化物等物质,形成了PH小于5.6的降水称为酸雨,请回答下列有关酸雨的问题:(1)已知 CO2的饱和溶液常温下pH不小于5.6.通常空气中CO2的含量大于SO2的含量,但人们反而将空气中的SO2认定为形成酸雨的主要原因之一.有同学想通过如图的实验寻找证据,你认为下一步的实验步骤是测定H2SO3溶液的pH,只要出现溶液pH小于5.6的实验结果,就可认定SO2溶于水有形成酸雨的可能.
(2)已知SO2与CO2有许多化学性质是相似的,亚硫酸钙(CaSO3 )是白色难溶于水但可溶于酸的固体.某同学向一酸雨样品中滴加 CaCl2,溶液本观察到有浑浊现象,继续滴入NaOH溶液后即有白色沉淀产生.在以上实验过程中,下列不可能发生的化学反应是A
A.SO2+CaCl2+H2O═CaSO3↓十2HCI
B.SO2+2NaOH═Na2SO3+H2O
C.Na2SO3+CaCl2═CaSO3↓+2NaCI
D.H2SO3+2NaOH═Na2SO3+2H2O.
分析 (1)依据题干信息结合设计的实验可知,只要是证明亚硫酸的溶液pH能小于5.6即可完成相关的验证.
(2)依据对实验过程的叙述结合酸雨的成分和物之间的反应规律进行判断即可;
解答 解:(1)二氧化硫溶于水会生成亚硫酸,二氧化碳溶于水会生成碳酸,而CO2的饱和溶液常温下pH不小于 5.6,所以要想证明二氧化硫是形成酸雨的主要成分,只要证明实验中亚硫酸的溶液pH能小于5.6即可.
(2)某同学向一酸雨样品中滴加 CaCl2,溶液未观察到有浑浊现象,说明没有发生A反应,因为A反应进行时会有白色沉淀产生,能溶于HCl,所以两者也不可能同时生成,由于二氧化硫和二氧化碳性质相似,所以B反应能够发生,继续滴入NaOH溶液后即有白色沉淀产生,说明发生了C反应,同时溶液中含有的亚硫酸也可与氢氧化钠发生中和反应,所以D反应可能发生;
故答案为:(1)H2SO3溶液的pH;溶液pH小于5.6;(2)A;
点评 此题是一道与酸雨相关的考查题,涉及到酸雨的形成及实验验证,借助题干信息结合相关的所学知识是解题的关键所在;

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
2.酸和碱的共同点是( )
| A. | 都含有氧元素 | B. | 都含有氢元素 | ||
| C. | 都能使无色酚酞变色 | D. | 都含有原子团 |
19.除去氧化铜粉末中少量炭粉的方法是( )
| A. | 加足量水,过滤 | B. | 在氧气流中加热 | C. | 在氢气流中加热 | D. | 加热混合物 |
3.下列获得氧气的方法中,属于物理变化的是( )
| A. | 过氧化氢与二氧化锰混合 | B. | 加热高锰酸钾 | ||
| C. | 分离液态空气 | D. | 将水通电分解 |
 (1)化学兴趣小组的同学经认真思考后,认为可选用如图装置进行收集氧气.若集气 瓶中的气体是空气,那么进气口应是a(填“a”或“b”),验满的方法是在导管b处用带火星的木条检查,如果复燃即收集满了;将此装置倒置后,气体从a端进入集气,该气体必须具有的性质是密度比空气小,不与氧气反应;
(1)化学兴趣小组的同学经认真思考后,认为可选用如图装置进行收集氧气.若集气 瓶中的气体是空气,那么进气口应是a(填“a”或“b”),验满的方法是在导管b处用带火星的木条检查,如果复燃即收集满了;将此装置倒置后,气体从a端进入集气,该气体必须具有的性质是密度比空气小,不与氧气反应; 表示汞原子,
表示汞原子, 表示氧原子):
表示氧原子):