题目内容
1.不用外加试剂把下列溶液鉴别出来的先后顺序正确的是( )①CuCl2 ②NaNO3 ③MgCl2 ④NaOH.
| A. | ①②③④ | B. | ①③④② | C. | ④①②③ | D. | ①④③② |
分析 有些物质的水溶液呈现一定的颜色,根据水溶液的颜色可以确定溶液中的溶质.由于铜盐溶液与碱溶液能生成蓝色沉淀,因此可以由铜盐溶液来确定碱溶液.由于碱溶液能与一些盐溶液生成沉淀,因此可以由碱溶液来确定一部分盐.
解答 解:由于氯化铜溶液呈蓝色,因此可以用观察的方法首先确定出氯化铜溶液.
由于氯化铜溶液与氢氧化钠溶液能生成蓝色沉淀氢氧化铜,因此可以将其它溶液取少量与试管中,分别滴入几滴氯化铜溶液,能产生蓝色沉淀的就是氢氧化钠溶液.
由于氢氧化钠溶液与氯化镁溶液能生成白色沉淀氢氧化镁,而与硝酸钠溶液不反应,接触时没有现象产生,因此可以将其它两种溶液各取少量于试管中,分别滴入几滴氢氧化钠溶液,有白色沉淀生成的是氯化镁溶液,没有沉淀生成的是硝酸钠溶液.
因此鉴别出各物质的顺序是①④③②.
故选D.
点评 本题主要考查铜盐溶液、碱溶液、盐溶液的性质,难度稍大.

练习册系列答案
相关题目
11.下列关于氧气的说法正确的是( )
| A. | 氧气易溶于水 | |
| B. | 食物腐败不需要氧气 | |
| C. | 硫在氧气中燃烧生成二氧化硫 | |
| D. | 氧气是一种化学性质比较活泼的气体 |
12.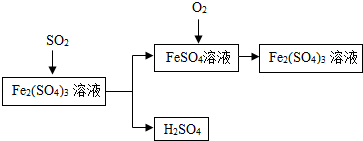 含硫煤燃烧会产生SO2造成大气污染,某工厂设计了如下工艺流程,防治污染的同时可以得到化工产品,下列叙述不正确的是( )
含硫煤燃烧会产生SO2造成大气污染,某工厂设计了如下工艺流程,防治污染的同时可以得到化工产品,下列叙述不正确的是( )
 含硫煤燃烧会产生SO2造成大气污染,某工厂设计了如下工艺流程,防治污染的同时可以得到化工产品,下列叙述不正确的是( )
含硫煤燃烧会产生SO2造成大气污染,某工厂设计了如下工艺流程,防治污染的同时可以得到化工产品,下列叙述不正确的是( )| A. | 该流程中可得到化工产品H2SO4 | |
| B. | 该流程中化合价发生改变的元素为Fe和S | |
| C. | 流程中涉及到的反应之一为:Fe(SO4)3+SO2+2H2O=2FeSO4+2H2SO4 | |
| D. | 该工艺流程中Fe2(SO4)3溶液可以循环使用 |
16.不能和水发生化合反应生成相应碱的是( )
| A. | 氧化钾 | B. | 氧化铁 | C. | 氧化钙 | D. | 氧化钡 |
6.铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工业上经过下列工艺可以冶炼金属铝:
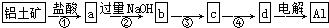
下列说法中错误的是( )
下列说法中错误的是( )
| A. | ①②中除加试剂外,还需要进行过滤操作 | |
| B. | a、b中铝元素的化合价相同 | |
| C. | ③中需要通入过量的氨气 | |
| D. | ④进行的操作是加热,而且d一定是氧化铝 |
11.氢化钙固体是登山运动员常用的能源提供剂.某探究小组的同学通过查阅资料得知,氢化钙(CaH2)遇水反应生成氢氧化钙和氢气.探究小组的同学把一定量的CaH2加入Na2CO3溶液中,充分反应后过滤,得到滤渣和滤液.经检验滤渣的成分是碳酸钙.
[提出问题]滤液中溶质的成分是什么?
[猜想与假设]
猜想一:NaOH 猜想二:NaOH、Ca(OH)2
猜想三:NaOH、Na2CO3 猜想四:NaOH、Na2CO3、Ca(OH)2
经讨论,大家认为猜想四不合理,请用化学方程式说明原因Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
[实验验证]
[反思与拓展]
(1)若向NH4Cl的溶液中加一定量CaH2,充分反应,产生的气体是氢气、氨气.
(2)登山运动员常用CaH2作为能源提供剂,与氢气相比,其优点是携带安全.
[提出问题]滤液中溶质的成分是什么?
[猜想与假设]
猜想一:NaOH 猜想二:NaOH、Ca(OH)2
猜想三:NaOH、Na2CO3 猜想四:NaOH、Na2CO3、Ca(OH)2
经讨论,大家认为猜想四不合理,请用化学方程式说明原因Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
[实验验证]
| 实验 | 现象 | 结论 |
| 实验一:取滤液,向其中滴入少量碳酸钠溶液 | 无明显现象 | 猜想二不成立 |
| 实验二:另取滤液,向其中加入足量稀盐酸 | 先无变化后产生气泡 | 猜想三成立 |
(1)若向NH4Cl的溶液中加一定量CaH2,充分反应,产生的气体是氢气、氨气.
(2)登山运动员常用CaH2作为能源提供剂,与氢气相比,其优点是携带安全.
12.某工厂用电解饱和食盐水的方法生产氯气、烧碱、氢气等化工产品,反应的化学方程式为:2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.某研究性学习兴趣小组对该厂生产的烧碱样品进行如下探究.
【提出问题】烧碱样品中含有哪些杂质?
【猜想】(1)可能含有NaCl,作出此猜想的依据是电解的过程中氯化钠没有完全反应.
(2)可能含有碳酸钠,做出此猜想的理由是CO2+2NaOH=Na2CO3+H2O(用化学方程式表示).
【实验设计】
【反思】小明认为上述实验不能说明样品中含有氯化钠,理由是在步骤②中加入盐酸时引入了氯离子.
【提出问题】烧碱样品中含有哪些杂质?
【猜想】(1)可能含有NaCl,作出此猜想的依据是电解的过程中氯化钠没有完全反应.
(2)可能含有碳酸钠,做出此猜想的理由是CO2+2NaOH=Na2CO3+H2O(用化学方程式表示).
【实验设计】
| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量的烧碱样品置于试管中加水溶解,用手触摸试管外壁. | 试管外壁发热 | 原因是氢氧化钠溶于水时放出热量 |
| ②向①所得的溶液中加入盐酸至过量. | 开始时无明显现象,过一段时间后有气泡产生. | 说明样品中含有杂质Na2CO3 |
| ③向②所得的溶液中加入硝酸银溶液. | 有白色沉淀产生. | AgNO3+NaCl═AgCl↓+NaNO3 说明样品中含有杂质氯化钠 |