题目内容
20.某化学兴趣小组利用图1装置探究制取气体的原理、方法及性质.结合装置图,回答下列问题: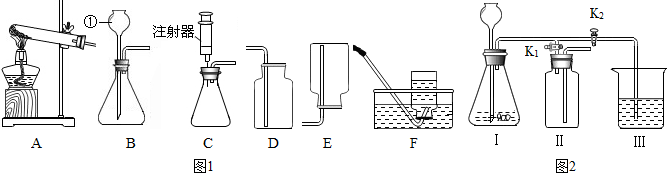
请回答下列问题:
(1)图中标有①的仪器名称是长颈漏斗.
(2)实验室用氯酸钾和二氧化锰混合制取氧气,应选用发生装置A(填字母序号,下同),反应的化学方程式为2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;实验室用过氧化氢溶液和二氧化锰制取氧气,若选用C做发生装置,你认为选用C的优点是可控制反应速率,节约药品.
(3)实验室制取氢气的化学方程式为Zn+H2SO4═ZnSO4+H2↑,选用的收集装置是E(或F).实验室常用氯化铵固体与熟石灰固体共热来制取氨气(NH3),应选择的装置组合是AE.
(4)该小组设计了如图2所示的实验装置,既可用于制取气体,又可用于探究物质性质.
①当打开K1、关闭K2时,利用 I、Ⅱ装置,可进行的实验是b(填字母).
a.大理石与稀盐酸反应制取二氧化碳
b.锌与稀硫酸反应制取氢气
②当打开K2、关闭K1时,可以利用 I、Ⅲ装置制得二氧化碳并验证其性质.若要证明二氧化碳能与水发生反应,应向烧杯的水中加入紫色的石蕊溶液.
分析 (1)据常用仪器回答;
(2)用加热氯酸钾和二氧化锰混合物的方法制取氧气属于固体加热型,故选发生装置A,并据反应原理书写方程式;C中注射器可逐滴滴加液体,可控制反应速率;
(3)实验室制取氢气用锌粒和稀硫酸,二者反应生成硫酸锌和氢气,据此书写方程式,氢气密度比空气小,不溶于水,所以可用向下排空气法或排水法收集;用氯化铵固体与熟石灰固体共热来制取氨气(NH3)属于固体加热型,故选发生装置A,并根据氨气的密度和溶解性选择收集收集方法;
(4)①根据发生装置和收集方法的特点分析;
②根据二氧化碳能与水发生反应产生碳酸,显酸性回答.
解答 解:(1)从图中仪器可知a是长颈漏斗;
(2)(2)用加热氯酸钾和二氧化锰混合物的方法制取氧气属于固体加热型,故选发生装置A,氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,反应的化学方程式为:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;
装置C滴加液体的仪器是注射器,用注射器代替长颈漏斗,可以使滴加的液体随加随停,可控制产生气体的速率,节约药品;
(3)实验室制取氢气常采用锌和稀硫酸来制取氢气,锌和稀硫酸在常温下反应生成硫酸锌和氢气,反应的化学方程式为:Zn+H2SO4═ZnSO4+H2↑;
氢气的相对分子质量是2<29,密度比空气小,所以可用向下排空气法收集,不溶于水,可用排水法收集;用氯化铵固体与熟石灰固体共热来制取氨气(NH3)属于固体加热型,故选发生装置A,氨气易溶于水,所以不能用排水法收集,相对分子质量是14+3=17<29,密度比空气小,所以用向下排空气法收集;
(4)①当打开K1、关闭K2时,利用I、Ⅱ装置,可制取的气体是固液常温型的气体制取且该气体的密度比空气小;锌与稀硫酸反应制取氢气的发生装置特点属于固液常温型,且氢气的密度比空气小,故选择b;
②二氧化碳能与水发生反应产生碳酸,显酸性,可以利用紫色的石蕊试液变成红色进行证明;
故答案为:(1)长颈漏斗;
(2)A;2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;B;可控制反应速率,节约药品;
(3)Zn+H2SO4═ZnSO4+H2↑;E (或F);AE;
(4)①b; ②紫色的石蕊溶液.
点评 本题考查了实验室制取气体的发生装置、收集方法的选择以及气体的性质检验,可依据气体发生装置、收集方法的依据及气体的性质等知识逐一分析.

 阅读快车系列答案
阅读快车系列答案| A. | 溶液的质量减少 | B. | 溶剂的质量减少 | ||
| C. | 溶液的密度不变 | D. | 溶质的质量分数减小 |
| A. | 滤液中一定有H2SO4、Na2SO4 | B. | 滤液中一定有Na2SO4、ZnSO4 | ||
| C. | 滤液中可能有H2SO4、ZnSO4 | D. | 滤液中可能有Na2SO4、NaOH |
 今年的化学实验操作考试有“制取并收集一瓶二氧化碳”的考题.
今年的化学实验操作考试有“制取并收集一瓶二氧化碳”的考题.(1)实验室制取二氧化碳选用的发生装置和收集装置为BD(填序号),反应的化学方程式为CaCO3+2HCl=CaCl2+CO2↑+H2O;
(2)化学兴趣小组的同学对反应后废液中溶质的成分进行进一步探究.
【提出问题】:废液中的溶质含有哪些物质
【猜想与假设】:猜想Ⅰ:溶液中的溶质只有CaCl2;
猜想Ⅱ:废液中的溶质有氯化钙和氯化氢.
【进行实验】:兴趣小组的同学取废液进行了以下实验,请你与他们一起完成下列实验报告.
| 实验操作 | 实验现象 | 实验结论 |
| 取少量反应后的废液于试管中,向其中加入Na2CO3溶液至过量 | 只有沉淀产生 | 猜想Ⅰ正确 |
| 先产生气泡 后产生沉淀 | 猜想Ⅱ正确 |
【反思拓展】:如果猜想Ⅱ正确,要使废液中只含有CaCl2,正确的处理方法是加入过量的碳酸钙.
| A. | 矿石粉碎 | B. | 铁钉生锈 | C. | 活性炭除臭 | D. | 霓虹灯闪烁 |
| A. | CaCl2 HCl NaNO3 | B. | KOH HCl (NH4)2SO4 | ||
| C. | K2CO3 Ba (NO3)2 NaOH | D. | FeCl3 NaCl KNO3 |
| A. | 木炭在氧气中燃烧 | B. | 湿衣服晾晒干 | ||
| C. | 食物腐败 | D. | 火药爆炸 |
| A. | 用一氧化碳还原氧化铁留下的黑色物质 | |
| B. | 用氢气还原氧化铜后留下的固体物质 | |
| C. | 久盛石灰水后留下的白膜 | |
| D. | 硫酸铜溶液与氢氧化钠溶液反应后留下的蓝色固体X |