36.[化学-选修物质结构与性质](15分)
下面的表格是元素周期表的一部分,其中的字母对应不同的元素。(用元素符号回答问题)
|
A |
|
|
|||||||||||||||
|
|
|
|
|
M |
Q |
R |
|
|
|||||||||
|
|
|
E |
|
B |
|
D |
|
||||||||||
|
|
|
|
G |
|
|
|
|
|
|
L |
|
|
|
C |
|
|
|
请回答下列问题:
(1)M、Q、R按第一电离能由小到大的顺序为 。
(2)Q元素的氢化物分子的立体结构呈 形,该分子属于 分子(填“极性”或“非极性”),中心原子呈 杂化方式;
(3)写出L基态原子核外电子排布式 ,L的硫酸盐溶液中加入过量Q的氢化物的水溶液可得深蓝色溶液,请写出该溶液显深蓝色的微粒的化学式 。
(4)已知AMQ分子是直线型分子,则其分子中含有σ键和π键的数目之比为 。
(5)试比较Q、B和C的氢化物沸点高低及热稳定性并说明理由 。
13. 通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的焓变(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
H---H |
Cl---Cl |
H---Cl |
|
生成1 mol化学键时所放出的能量(kJ·mol-1) |
436 |
243 |
431 |
则下列热化学方程式不正确的是( )
A.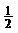 H2(g)+
H2(g)+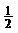 Cl2(g)=HCl (g) ΔH= ﹣91.5 kJ·mol-1
Cl2(g)=HCl (g) ΔH= ﹣91.5 kJ·mol-1
B. H2(g)+ Cl2(g)=2HCl (g) ΔH= ﹣183kJ·mol-1
C.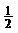 H2(g)+
H2(g)+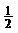 Cl2(g)=HCl (g) ΔH= ﹢91.5 kJ·mol-1
Cl2(g)=HCl (g) ΔH= ﹢91.5 kJ·mol-1
D.2HCl(g) =H2(g)+ Cl2(g) ΔH= ﹢183kJ·mol-1
11. 在一体积可变的密闭容器里,加入一定量的M、N,发生反应aM(g)+bN(g) cP(g),△H =Q kJ·mol-1,反应达平衡时,P的物质的量浓度(mol·L-1)与容器体积和温度的关系如下表,其中,说法正确的是( )
cP(g),△H =Q kJ·mol-1,反应达平衡时,P的物质的量浓度(mol·L-1)与容器体积和温度的关系如下表,其中,说法正确的是( )
  c(P) c(P)
|
1 L |
2 L |
3 L |
||||
|
100℃ |
1.30 |
1.00 |
0.70 |
||||
|
200℃ |
1.20 |
0.90 |
0.62 |
||||
|
300℃ |
1.00 |
0.75 |
0.53 |
A.Q>0
B.温度不变,扩大容器体积,正反应速率增大,逆反应速率减小
C.容器体积不变,升高温度,平衡体系中M的体积百分含量减小
D. a+b<c
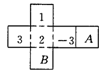
 形内分别填上-1,-2,使得按虚线折成正方体后,相对面上的两数互为相反数,则A处应填( ).
形内分别填上-1,-2,使得按虚线折成正方体后,相对面上的两数互为相反数,则A处应填( ).
 H2CO3+2OH -
H2CO3+2OH -