网址:http://m.1010jiajiao.com/timu_id_4461983[举报]
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”=):SiC_______Si;SiCl4_______SiO2。
(2)图1-1立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子。
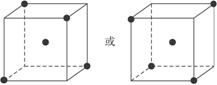
图1-1
查看习题详情和答案>>化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
工业上高纯硅可通过下列反应制取:
SiCl4(g)+2H2(g) ![]() Si(s)+4HCl (g)
Si(s)+4HCl (g)
该反应的反应热ΔH=______________kJ·mol -1
查看习题详情和答案>>化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)
SiC_________Si;SiCl4_____________SiO2
(2)图3-9中立方体中心的“·”表示硅晶体中的一个原子,请在立方体的顶点用“·”表示出与之紧邻的硅原子。
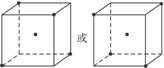
图3-9
(3)工业上高纯硅可通过下列反应制取:
SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g)
Si(s)+4HCl(g)
该反应的反应热ΔH_______=kJ·mol-1
查看习题详情和答案>>化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”=SiC______Si;SiCl4______SiO2。
(2)图中立方体中心的“![]() ”表示硅晶体中的一个原子,请在立方体的顶点用“
”表示硅晶体中的一个原子,请在立方体的顶点用“![]() ”表示出与之紧邻的硅原子。
”表示出与之紧邻的硅原子。

(3)工业上高纯硅可通过下列反应制取:
SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),该反应的反应热ΔH=______kJ·mol-1。
Si(s)+4HCl(g),该反应的反应热ΔH=______kJ·mol-1。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
请完成下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)SiC_________Si;SiCl4_________SiO2。

(2)上图立方体中心的“![]() ”表示硅晶体中的一个原子,请在立方体的顶点用“
”表示硅晶体中的一个原子,请在立方体的顶点用“![]() ”表示出与之紧邻的硅原子。
”表示出与之紧邻的硅原子。
(3)工业上高纯硅可通过下列反应制取:
SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g)
Si(s)+4HCl(g)
该反应的反应热ΔH=_________kJ·mol-1。
查看习题详情和答案>>