铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式__________。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。正极反应______,负极反应___________。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+
的实验步骤: 。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ Fe2+ Cu2+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
|
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。有关反应的化学方程式 、 劣质不锈钢腐蚀的实验现象: 。
解析:本题第三问涉及应用FeCl3水解的知识除杂的问题,欲一起除去CuCl2溶液中Fe3+和Fe2+,应该首先将Fe2+氧化为Fe3+,然后加入氧化铜调节溶液的pH,氧化铜与Fe3+水解生成的H+反应,促进Fe3+水解平衡正向移动生成Fe(OH)3沉淀而除去。
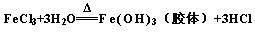
 Fe(OH)3+3HCl,离子方程式为Fe3++3H2O
Fe(OH)3+3HCl,离子方程式为Fe3++3H2O