1、化学能转化为电能的方式:
|
电能 (电力) |
火电(火力发电) |
化学能→热能→机械能→电能 |
缺点:环境污染、低效 |
|
原电池 |
将化学能直接转化为电能 |
优点:清洁、高效 |
3、能源的分类:
|
形成条件 |
利用历史 |
性质 |
|
|
一次能源 |
常规能源 |
可再生资源 |
水能、风能、生物质能 |
|
不可再生资源 |
煤、石油、天然气等化石能源 |
||
|
新能源 |
可再生资源 |
太阳能、风能、地热能、潮汐能、氢能、沼气 |
|
|
不可再生资源 |
核能 |
||
|
二次能源 |
(一次能源经过加工、转化得到的能源称为二次能源) 电能(水电、火电、核电)、蒸汽、工业余热、酒精、汽油、焦炭等 |
[思考]一般说来,大多数化合反应是放热反应,大多数分解反应是吸热反应,放热反应都不需要加热,吸热反应都需要加热,这种说法对吗?试举例说明。
点拔:这种说法不对。如C+O2=CO2的反应是放热反应,但需要加热,只是反应开始后不再需要加热,反应放出的热量可以使反应继续下去。Ba(OH)2·8H2O与NH4Cl的反应是吸热反应,但反应并不需要加热。
[练习]1、下列反应中,即属于氧化还原反应同时又是吸热反应的是( )
A.Ba(OH)2.8H2O与NH4Cl反应 B.灼热的炭与CO2反应
C.铝与稀盐酸 D.H2与O2的燃烧反应
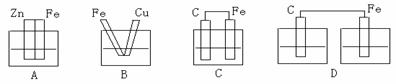 [练习]3、下图各装置中,溶液均为稀硫酸,不能构成原电池的是( )
[练习]3、下图各装置中,溶液均为稀硫酸,不能构成原电池的是( ) 2CO是吸热反应)。
2CO是吸热反应)。