摘要:原电池原理 (1)概念:把化学能直接转化为电能的装置叫做原电池. (2)原电池的工作原理:通过氧化还原反应把化学能转变为电能. (3)构成原电池的条件:(1)电极为导体且活泼性不同,(2)两个电极接触,(3)两个相互连接的电极插入电解质溶液构成闭合回路. (4)电极名称及发生的反应: 负极:较活泼的金属作负极.负极发生氧化反应. 电极反应式:较活泼金属-ne-=金属阳离子 负极现象:负极溶解.负极质量减少. 正极:较不活泼的金属或石墨作正极.正极发生还原反应. 电极反应式:溶液中阳离子+ne-=单质 正极的现象:一般有气体放出或正极质量增加. (5)原电池正负极的判断方法: ①依据原电池两极的材料: 较活泼的金属作负极(K.Ca.Na太活泼.不能作电极), 较不活泼金属或可导电非金属.氧化物(MnO2)等作正极. ②根据电流方向或电子流向:的电流由正极流向负极,电子则由负极经外电路流向原电池的正极. ③根据内电路离子的迁移方向:阳离子流向原电池正极.阴离子流向原电池负极. ④根据原电池中的反应类型: 负极:失电子.发生氧化反应.现象通常是电极本身消耗.质量减小. 正极:得电子.发生还原反应.现象是常伴随金属的析出或H2的放出. (6)原电池电极反应的书写方法: (i)原电池反应所依托的化学反应原理是氧化还原反应.负极反应是氧化反应.正极反应是还原反应.因此书写电极反应的方法归纳如下: ①写出总反应方程式. ②把总反应根据电子得失情况.分成氧化反应.还原反应. ③氧化反应在负极发生.还原反应在正极发生.反应物和生成物对号入座.注意酸碱介质和水等参与反应. (ii)原电池的总反应式一般把正极和负极反应式相加而得. (7)原电池的应用:①加快化学反应速率.如粗锌制氢气速率比纯锌制氢气快.②比较金属活动性强弱.③设计原电池.④金属的腐蚀.
网址:http://m.1010jiajiao.com/timu_id_4411778[举报]
(2011?海淀区二模)2010年上海世博会的主题是“城市,让生活更美好”.请回答下列问题:
(1)在世博会中应用了下列技术,其中能有效实现“节能环保”的是(填字母序号,下同)
a.采用水循环为场馆降温 b.用竹、藤等天然材料建造场馆 c.构建生态绿化墙面
(2)①由上汽集团自主研发的“叶子”概念车(如图所示)在中国馆低碳区展出,该车顶部的“大叶子”是一部光电转化器,其作用把
②纳米TiO2晶体太阳能电池近年来受到国内外科学家的重视.从物质分类来看,TiO2属于
a.金属单质 b.氧化物 c.酸 d.碱 e.盐
③生活中常用的燃料有
(3)南翔小笼包是上海小吃的典型代表.制作南翔小笼包的主要原料是:面粉、肥瘦搭配的猪肉馅.南翔小笼包提供的营养素主要有
(4)世博园区内有许多饮水台,可取水直接饮用.其中的饮用水处理步骤如图所示;

步骤①中活性炭的作用是
查看习题详情和答案>>
(1)在世博会中应用了下列技术,其中能有效实现“节能环保”的是(填字母序号,下同)
abc
abc
a.采用水循环为场馆降温 b.用竹、藤等天然材料建造场馆 c.构建生态绿化墙面

(2)①由上汽集团自主研发的“叶子”概念车(如图所示)在中国馆低碳区展出,该车顶部的“大叶子”是一部光电转化器,其作用把
太阳光
太阳光
能转化为电能.②纳米TiO2晶体太阳能电池近年来受到国内外科学家的重视.从物质分类来看,TiO2属于
b
b
a.金属单质 b.氧化物 c.酸 d.碱 e.盐
③生活中常用的燃料有
煤
煤
、石油、天然气,它们被称为化石燃料.(3)南翔小笼包是上海小吃的典型代表.制作南翔小笼包的主要原料是:面粉、肥瘦搭配的猪肉馅.南翔小笼包提供的营养素主要有

abc
abc
a.糖类 b.油脂 c.蛋白质(4)世博园区内有许多饮水台,可取水直接饮用.其中的饮用水处理步骤如图所示;

步骤①中活性炭的作用是
吸附和过滤杂质
吸附和过滤杂质
.
2010年上海世博会的主题是“城市,让生活更美好”.请回答下列问题:
(1)在世博会中应用了下列技术,其中能有效实现“节能环保”的是(填字母序号,下同)
a.采用水循环为场馆降温 b.用竹、藤等天然材料建造场馆 c.构建生态绿化墙面
(2)①由上汽集团自主研发的“叶子”概念车(如图所示)在中国馆低碳区展出,该车顶部的“大叶子”是一部光电转化器,其作用把 能转化为电能.
②纳米TiO2晶体太阳能电池近年来受到国内外科学家的重视.从物质分类来看,TiO2属于
a.金属单质 b.氧化物 c.酸 d.碱 e.盐
③生活中常用的燃料有 、石油、天然气,它们被称为化石燃料.
(3)南翔小笼包是上海小吃的典型代表.制作南翔小笼包的主要原料是:面粉、肥瘦搭配的猪肉馅.南翔小笼包提供的营养素主要有
a.糖类 b.油脂 c.蛋白质
(4)世博园区内有许多饮水台,可取水直接饮用.其中的饮用水处理步骤如图所示;
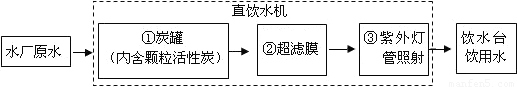
步骤①中活性炭的作用是 .
 查看习题详情和答案>>
查看习题详情和答案>>
(1)在世博会中应用了下列技术,其中能有效实现“节能环保”的是(填字母序号,下同)
a.采用水循环为场馆降温 b.用竹、藤等天然材料建造场馆 c.构建生态绿化墙面
(2)①由上汽集团自主研发的“叶子”概念车(如图所示)在中国馆低碳区展出,该车顶部的“大叶子”是一部光电转化器,其作用把 能转化为电能.
②纳米TiO2晶体太阳能电池近年来受到国内外科学家的重视.从物质分类来看,TiO2属于
a.金属单质 b.氧化物 c.酸 d.碱 e.盐
③生活中常用的燃料有 、石油、天然气,它们被称为化石燃料.
(3)南翔小笼包是上海小吃的典型代表.制作南翔小笼包的主要原料是:面粉、肥瘦搭配的猪肉馅.南翔小笼包提供的营养素主要有

a.糖类 b.油脂 c.蛋白质
(4)世博园区内有许多饮水台,可取水直接饮用.其中的饮用水处理步骤如图所示;

步骤①中活性炭的作用是 .
 查看习题详情和答案>>
查看习题详情和答案>>