摘要:28.实验室里.老师为同学们提供了如图的实验装置.准备用高锰酸钾制取氧气.(1)指出发生装置A中任意一种玻璃仪器的名称: (2)A中发生反应的化学反应式或化学方程式是 (3)A中有一处明显的错误是 A (4)实验步骤有:①将高锰酸钾加入试管中.②检查装置的气密性,③加热试管,④把试管固定在铁架台上,⑤用排水法收集气体,⑥熄灭酒精灯, ⑦将导管移出水面.正确的步骤排序为 (5)用B所示的方法收集气体.其优点是所得气体比较 .在实验过程中.如何判断集气瓶中无水? .除此以外.氧气还可以用向上排空气法收集.其依据是 (6)除了高锰酸钾能制取氧气外.氯酸钾也能用此方法来产生氧气.不过速度较慢.但是如果在氯酸钾中加入一些二氧化锰.则大大加快了反应速率.二氧化锰的质量和化学性质没有改变.则这里的二氧化锰 (填“是 或“不是 )催化剂.若在氯酸钾中加入一些高锰酸钾.也能大大加快反应速率.高锰酸钾 催化剂.理由是
网址:http://m.1010jiajiao.com/timu_id_885143[举报]
实验室里,老师为同学们提供了如图的实验装置,准备用高锰酸钾制取氧气。
(1)指出发生装置A中任意一种玻璃仪器的名称:
(2)A中发生反应的化学反应式或化学方程式是
(3)A中有一处明显的错误是 A
(4)实验步骤有:①将高锰酸钾加入试管中,
②检查装置的气密性;
③加热试管;
④把试管固定在铁架台上;
⑤用排水法收集气体;
⑥熄灭酒精灯;
⑦将导管移出水面。正确的步骤排序为
(5)用B所示的方法收集气体,其优点是所得气体比较 ,在实验过程中,如何判断集气瓶中无水? ,除此以外,氧气还可以用向上排空气法收集,其依据是
(6)除了高锰酸钾能制取氧气外,氯酸钾也能用此方法来产生氧气,不过速度较慢。但是如果在氯酸钾中加入一些二氧化锰,则大大加快了反应速率,二氧化锰的质量和化学性质没有改变,则这里的二氧化锰 (填“是”或“不是”)催化剂。若在氯酸钾中加入一些高锰酸钾,也能大大加快反应速率,高锰酸钾 (填“是”或“不是”)催化剂,理由是
查看习题详情和答案>>(2010?广安)某化学兴趣小组在化学实验室发现一瓶没有标签的淡黄色粉末,同学们对探究该粉末产生浓厚兴趣,并在老师的指导下进行探究活动.
【提出问题】这种淡黄色粉末是什么?有什么性质和用途?
【查阅资料】①硫是淡黄色粉末,不溶于水;
②过氧化钠(Na2O2)是淡黄色粉末,在常温下能与水反应生成碱和一种气体;在呼吸面具中和潜水艇里常用作供氧剂.
【提出猜想】淡黄色粉末可能是:a.硫; b.过氧化钠; c.硫和过氧化钠的混合物.
【实验探究一】过氧化钠与水反应的生成物是什么?
(1)取适量的该粉末于试管中,加入足量蒸馏水产生气泡,证明猜想
(2)用带火星的木条伸入反应的试管中,木条复燃,说明产生
(3)充分反应后,试管中只得到无色溶液;向溶液中滴加
(4)写出过氧化钠与水反应的化学方程式:
【实践探究二】过氧化钠为什么能作供氧剂?大家讨论认为可能是CO2在常温下能与过氧
化钠反应有关,于是设计如图所示的装置继续实验探究.
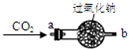
【实验结论】CO2在常温下能与过氧化钠反应,该反应的化学方程式为:
【交流比较】与我们学过的用KClO3或KMnO4制取氧气的方法相比,常选用过氧化钠作为呼吸面具和潜水艇的供氧剂的主要理由是(从两个不同角度回答):
查看习题详情和答案>>
【提出问题】这种淡黄色粉末是什么?有什么性质和用途?
【查阅资料】①硫是淡黄色粉末,不溶于水;
②过氧化钠(Na2O2)是淡黄色粉末,在常温下能与水反应生成碱和一种气体;在呼吸面具中和潜水艇里常用作供氧剂.
【提出猜想】淡黄色粉末可能是:a.硫; b.过氧化钠; c.硫和过氧化钠的混合物.
【实验探究一】过氧化钠与水反应的生成物是什么?
(1)取适量的该粉末于试管中,加入足量蒸馏水产生气泡,证明猜想
a
a
不成立;(2)用带火星的木条伸入反应的试管中,木条复燃,说明产生
氧气
氧气
;(3)充分反应后,试管中只得到无色溶液;向溶液中滴加
无色酚酞试液
无色酚酞试液
,观察到酚酞试液体变红
酚酞试液体变红
,证明生成物中有NaOH;同时证明猜想b
b
成立.(4)写出过氧化钠与水反应的化学方程式:
2Na2O2+2H2O═4NaOH+O2↑
2Na2O2+2H2O═4NaOH+O2↑
.【实践探究二】过氧化钠为什么能作供氧剂?大家讨论认为可能是CO2在常温下能与过氧
化钠反应有关,于是设计如图所示的装置继续实验探究.

| 实 验 操 作 | 实 验 现 象 |
| ①将CO2从a口处通入装置内,再把带火星的木条放在装置b口处 | 木条复燃 |
| ②取出充分反应后的固体生成物于试管中,往试管内滴加稀盐酸,将生成的气体通入澄清石灰水中 | 有气泡产生, 石灰水变浑浊 |
2CO2+2Na2O2=2Na2CO3+O2↑
2CO2+2Na2O2=2Na2CO3+O2↑
【交流比较】与我们学过的用KClO3或KMnO4制取氧气的方法相比,常选用过氧化钠作为呼吸面具和潜水艇的供氧剂的主要理由是(从两个不同角度回答):
反应在常温下进行
反应在常温下进行
、反应消耗了人体呼出的二氧化碳气体
反应消耗了人体呼出的二氧化碳气体
.某班在实验室上复习课,主题是常见气体的制备,老师准备了部分药品,并提供了以下装置,请分析同学们的操作后填写下列空白.
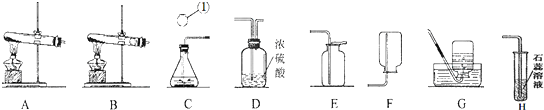
(1)写出装置中标号仪器的名称:①
(2)赵江同学领取了高锰酸钾固体,准备制取一瓶氧气,他应选用的发生装置是
(3)李睛同学自带了石灰石、领取了浓盐酸,把药品都装入C后,将C与H相连接时,紫色石蕊试液变红,于是提出了以下假设:
假设1 CO2使石蕊试液变红
假设2 H2CO3使石蕊试液变红
假设3
根据你曾经做过的实验,假设
(4)王红同学从家里带来了过氧化氢溶液,要想顺利制得氧气,需要与
并据此选择图中
查看习题详情和答案>>

(1)写出装置中标号仪器的名称:①
长颈漏斗
长颈漏斗
.(2)赵江同学领取了高锰酸钾固体,准备制取一瓶氧气,他应选用的发生装置是
B
B
(填字母),该反应的化学方程式为:2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
.
| ||
(3)李睛同学自带了石灰石、领取了浓盐酸,把药品都装入C后,将C与H相连接时,紫色石蕊试液变红,于是提出了以下假设:
假设1 CO2使石蕊试液变红
假设2 H2CO3使石蕊试液变红
假设3
HCl
HCl
使石蕊试液变红.根据你曾经做过的实验,假设
假设1
假设1
不成立.(4)王红同学从家里带来了过氧化氢溶液,要想顺利制得氧气,需要与
赵江
赵江
同学(填“赵江”或“李晴”)合作,利用双方的药品制取氧气,反应的化学方程式为:2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
并据此选择图中
CDE
CDE
(填字母)组装一套制取收集干燥氧气的装置,收集氧气时,验满的方法是把带火星的小木条放在集气瓶口,如复燃,则满
把带火星的小木条放在集气瓶口,如复燃,则满
.28、某化学兴趣小组的同学在实验室配制10%的氢氧化钠溶液、5%的硫酸、20%的硫酸三种溶液.
(1)配制20%的硫酸的步骤:①稀释 ②计算 ③装瓶并贴标签 ④量取浓硫酸和水.其正确的顺序为
(2)稀释浓硫酸时,一定要把
(3)他们忘记了给配制的三瓶溶液贴上标签,想对未贴标签的三瓶溶液进行鉴别.老师只给他们提供了无色酚酞试液、试管和胶头滴管,如果你是小组的成员,请用简便的方法鉴别出三种溶液,并完成下列实验报告.
(4)如果实验室需要配制20%的硫酸100g,需要密度为1.84g/mL 质量分数为98%的浓硫酸
查看习题详情和答案>>
(1)配制20%的硫酸的步骤:①稀释 ②计算 ③装瓶并贴标签 ④量取浓硫酸和水.其正确的顺序为
②④①③
(填序号).(2)稀释浓硫酸时,一定要把
把浓硫酸缓缓注入水里
,并不断搅拌.(3)他们忘记了给配制的三瓶溶液贴上标签,想对未贴标签的三瓶溶液进行鉴别.老师只给他们提供了无色酚酞试液、试管和胶头滴管,如果你是小组的成员,请用简便的方法鉴别出三种溶液,并完成下列实验报告.

(4)如果实验室需要配制20%的硫酸100g,需要密度为1.84g/mL 质量分数为98%的浓硫酸
11.1
mL.(保留一位小数)同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题:
[提出问题]1.金属钠能否置换出硫酸铜溶液中的铜?2.金属钠能否在其他气体(如:CO2)中燃烧?
[查阅资料]金属Na性质活泼,常温下,它极易与氧气反应生成白色固体氧化钠,氧化钠溶于水生成氢氧化钠.金属钠还可以与水剧烈反应放出氢气.
[实验探究]实验一:①在实验室中,金属钠保存在煤油中;②用镊子从煤油中取出一小块金属钠,用滤纸吸干表面煤油后投入硫酸铜溶液中,观察到溶液中出现蓝色沉淀,但没有红色的物质析出;
③按照步骤②将金属钠投入水中,待反应结束后滴加酚酞溶液,发现溶液变红.
实验二:将燃烧的钠迅速伸入盛有CO2的集气瓶中,观察到钠在CO2中继续燃烧,反应后冷却,瓶内附着黑色颗粒,并粘附着白色物质.
[问题讨论](1)金属钠保存在煤油中的原因
(2)根据上述资料写出钠块投入水中所发生的反应方程式:
(3)实验二中生成的黑色颗粒是
①同学们围绕白色物质可能是什么产生如下猜想:甲认为白色物质是Na2O,乙认为是Na2CO3,丙认为是Na2O和Na2CO3的混合物,丁认为是NaOH.
我认为认为丁的猜想是错误的,理由是
②对白色物质是什么进行实验再探究,方案设计如下:
方案1:取该样品少量于试管里,加入适量的水,振荡,过滤,向滤液中加入无色酚酞试液,观察到溶液变成红色,结论:白色物质中一定有Na2O.
方案2:取该样品少量于试管里,滴加足量稀盐酸,溶液中有气泡冒出,结论:白色物质中一定有
方案3:取该样品少量于试管里,加入适量的水,振荡,过滤,向滤液中加入过量的
③评价与反思:大家认为实验方案1得出的结论不正确,其理由是
实验室中的金属钠着火时,你的灭火方法是
[拓展应用]小明同学为测定实验过程中所用的标示质量分数为32%的盐酸 (图1)的实际质量分数,他与小组的其他同学用pH测定仪组成实验装置(图2).实验时先在烧杯中加入20g 40%的氢氧化钠溶液,再逐滴加人该盐酸,测定仪打印出加入盐酸的质量与烧杯中溶液pH的关系图(图3).

①发生反应的化学方程式为:
②请以此次测定的结果,可计算出该盐酸的实际质量分数是
③请分析你的计算结果与标签标示的质量分数不一致的可能原因:
查看习题详情和答案>>
[提出问题]1.金属钠能否置换出硫酸铜溶液中的铜?2.金属钠能否在其他气体(如:CO2)中燃烧?
[查阅资料]金属Na性质活泼,常温下,它极易与氧气反应生成白色固体氧化钠,氧化钠溶于水生成氢氧化钠.金属钠还可以与水剧烈反应放出氢气.
[实验探究]实验一:①在实验室中,金属钠保存在煤油中;②用镊子从煤油中取出一小块金属钠,用滤纸吸干表面煤油后投入硫酸铜溶液中,观察到溶液中出现蓝色沉淀,但没有红色的物质析出;
③按照步骤②将金属钠投入水中,待反应结束后滴加酚酞溶液,发现溶液变红.
实验二:将燃烧的钠迅速伸入盛有CO2的集气瓶中,观察到钠在CO2中继续燃烧,反应后冷却,瓶内附着黑色颗粒,并粘附着白色物质.
[问题讨论](1)金属钠保存在煤油中的原因
钠易与氧气反应变质
钠易与氧气反应变质
.(2)根据上述资料写出钠块投入水中所发生的反应方程式:
2Na+2H2O═2NaOH+H2↑
2Na+2H2O═2NaOH+H2↑
;钠投入硫酸铜溶液中总的反应方程式:2Na+2H2O+CuSO4=H2↑+Cu(OH)2↓+Na2SO4
2Na+2H2O+CuSO4=H2↑+Cu(OH)2↓+Na2SO4
.氢氧化铜受热分解成氧化铜和水,若将24.0g剩余固体继续高温加热,发现固体质量减少了2.4g后质量不再改变,写出此过程中可能发生反应的化学方程式:4CuO
2Cu2O+O2↑
| ||
4CuO
2Cu2O+O2↑
.
| ||
(3)实验二中生成的黑色颗粒是
C
C
,而白色物质可能是什么呢?①同学们围绕白色物质可能是什么产生如下猜想:甲认为白色物质是Na2O,乙认为是Na2CO3,丙认为是Na2O和Na2CO3的混合物,丁认为是NaOH.
我认为认为丁的猜想是错误的,理由是
反应物中没有氢元素
反应物中没有氢元素
.②对白色物质是什么进行实验再探究,方案设计如下:
方案1:取该样品少量于试管里,加入适量的水,振荡,过滤,向滤液中加入无色酚酞试液,观察到溶液变成红色,结论:白色物质中一定有Na2O.
方案2:取该样品少量于试管里,滴加足量稀盐酸,溶液中有气泡冒出,结论:白色物质中一定有
碳酸钠
碳酸钠
.方案3:取该样品少量于试管里,加入适量的水,振荡,过滤,向滤液中加入过量的
B
B
溶液(供选试剂:A.石灰水B.氯化钙溶液 C.硫酸铜溶液),出现白色沉淀,然后过滤,再向溶液里滴加无色酚酞试液,无明显现象出现.则乙
乙
(在甲、乙、丙中选)的猜想成立.③评价与反思:大家认为实验方案1得出的结论不正确,其理由是
碳酸钠溶液也是碱性的
碳酸钠溶液也是碱性的
;实验室中的金属钠着火时,你的灭火方法是
用黄沙掩埋
用黄沙掩埋
.[拓展应用]小明同学为测定实验过程中所用的标示质量分数为32%的盐酸 (图1)的实际质量分数,他与小组的其他同学用pH测定仪组成实验装置(图2).实验时先在烧杯中加入20g 40%的氢氧化钠溶液,再逐滴加人该盐酸,测定仪打印出加入盐酸的质量与烧杯中溶液pH的关系图(图3).

①发生反应的化学方程式为:
HCl+NaOH=NaCl+H2O
HCl+NaOH=NaCl+H2O
_.②请以此次测定的结果,可计算出该盐酸的实际质量分数是
29.2%
29.2%
.③请分析你的计算结果与标签标示的质量分数不一致的可能原因:
浓盐酸具有挥发性,长期放置质量分数减小
浓盐酸具有挥发性,长期放置质量分数减小
.