题目内容
同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题:
[提出问题]1.金属钠能否置换出硫酸铜溶液中的铜?2.金属钠能否在其他气体(如:CO2)中燃烧?
[查阅资料]金属Na性质活泼,常温下,它极易与氧气反应生成白色固体氧化钠,氧化钠溶于水生成氢氧化钠.金属钠还可以与水剧烈反应放出氢气.
[实验探究]实验一:①在实验室中,金属钠保存在煤油中;②用镊子从煤油中取出一小块金属钠,用滤纸吸干表面煤油后投入硫酸铜溶液中,观察到溶液中出现蓝色沉淀,但没有红色的物质析出;
③按照步骤②将金属钠投入水中,待反应结束后滴加酚酞溶液,发现溶液变红.
实验二:将燃烧的钠迅速伸入盛有CO2的集气瓶中,观察到钠在CO2中继续燃烧,反应后冷却,瓶内附着黑色颗粒,并粘附着白色物质.
[问题讨论](1)金属钠保存在煤油中的原因
(2)根据上述资料写出钠块投入水中所发生的反应方程式:
(3)实验二中生成的黑色颗粒是
①同学们围绕白色物质可能是什么产生如下猜想:甲认为白色物质是Na2O,乙认为是Na2CO3,丙认为是Na2O和Na2CO3的混合物,丁认为是NaOH.
我认为认为丁的猜想是错误的,理由是
②对白色物质是什么进行实验再探究,方案设计如下:
方案1:取该样品少量于试管里,加入适量的水,振荡,过滤,向滤液中加入无色酚酞试液,观察到溶液变成红色,结论:白色物质中一定有Na2O.
方案2:取该样品少量于试管里,滴加足量稀盐酸,溶液中有气泡冒出,结论:白色物质中一定有
方案3:取该样品少量于试管里,加入适量的水,振荡,过滤,向滤液中加入过量的
③评价与反思:大家认为实验方案1得出的结论不正确,其理由是
实验室中的金属钠着火时,你的灭火方法是
[拓展应用]小明同学为测定实验过程中所用的标示质量分数为32%的盐酸 (图1)的实际质量分数,他与小组的其他同学用pH测定仪组成实验装置(图2).实验时先在烧杯中加入20g 40%的氢氧化钠溶液,再逐滴加人该盐酸,测定仪打印出加入盐酸的质量与烧杯中溶液pH的关系图(图3).

①发生反应的化学方程式为:
②请以此次测定的结果,可计算出该盐酸的实际质量分数是
③请分析你的计算结果与标签标示的质量分数不一致的可能原因:
[提出问题]1.金属钠能否置换出硫酸铜溶液中的铜?2.金属钠能否在其他气体(如:CO2)中燃烧?
[查阅资料]金属Na性质活泼,常温下,它极易与氧气反应生成白色固体氧化钠,氧化钠溶于水生成氢氧化钠.金属钠还可以与水剧烈反应放出氢气.
[实验探究]实验一:①在实验室中,金属钠保存在煤油中;②用镊子从煤油中取出一小块金属钠,用滤纸吸干表面煤油后投入硫酸铜溶液中,观察到溶液中出现蓝色沉淀,但没有红色的物质析出;
③按照步骤②将金属钠投入水中,待反应结束后滴加酚酞溶液,发现溶液变红.
实验二:将燃烧的钠迅速伸入盛有CO2的集气瓶中,观察到钠在CO2中继续燃烧,反应后冷却,瓶内附着黑色颗粒,并粘附着白色物质.
[问题讨论](1)金属钠保存在煤油中的原因
钠易与氧气反应变质
钠易与氧气反应变质
.(2)根据上述资料写出钠块投入水中所发生的反应方程式:
2Na+2H2O═2NaOH+H2↑
2Na+2H2O═2NaOH+H2↑
;钠投入硫酸铜溶液中总的反应方程式:2Na+2H2O+CuSO4=H2↑+Cu(OH)2↓+Na2SO4
2Na+2H2O+CuSO4=H2↑+Cu(OH)2↓+Na2SO4
.氢氧化铜受热分解成氧化铜和水,若将24.0g剩余固体继续高温加热,发现固体质量减少了2.4g后质量不再改变,写出此过程中可能发生反应的化学方程式:4CuO
2Cu2O+O2↑
| ||
4CuO
2Cu2O+O2↑
.
| ||
(3)实验二中生成的黑色颗粒是
C
C
,而白色物质可能是什么呢?①同学们围绕白色物质可能是什么产生如下猜想:甲认为白色物质是Na2O,乙认为是Na2CO3,丙认为是Na2O和Na2CO3的混合物,丁认为是NaOH.
我认为认为丁的猜想是错误的,理由是
反应物中没有氢元素
反应物中没有氢元素
.②对白色物质是什么进行实验再探究,方案设计如下:
方案1:取该样品少量于试管里,加入适量的水,振荡,过滤,向滤液中加入无色酚酞试液,观察到溶液变成红色,结论:白色物质中一定有Na2O.
方案2:取该样品少量于试管里,滴加足量稀盐酸,溶液中有气泡冒出,结论:白色物质中一定有
碳酸钠
碳酸钠
.方案3:取该样品少量于试管里,加入适量的水,振荡,过滤,向滤液中加入过量的
B
B
溶液(供选试剂:A.石灰水B.氯化钙溶液 C.硫酸铜溶液),出现白色沉淀,然后过滤,再向溶液里滴加无色酚酞试液,无明显现象出现.则乙
乙
(在甲、乙、丙中选)的猜想成立.③评价与反思:大家认为实验方案1得出的结论不正确,其理由是
碳酸钠溶液也是碱性的
碳酸钠溶液也是碱性的
;实验室中的金属钠着火时,你的灭火方法是
用黄沙掩埋
用黄沙掩埋
.[拓展应用]小明同学为测定实验过程中所用的标示质量分数为32%的盐酸 (图1)的实际质量分数,他与小组的其他同学用pH测定仪组成实验装置(图2).实验时先在烧杯中加入20g 40%的氢氧化钠溶液,再逐滴加人该盐酸,测定仪打印出加入盐酸的质量与烧杯中溶液pH的关系图(图3).

①发生反应的化学方程式为:
HCl+NaOH=NaCl+H2O
HCl+NaOH=NaCl+H2O
_.②请以此次测定的结果,可计算出该盐酸的实际质量分数是
29.2%
29.2%
.③请分析你的计算结果与标签标示的质量分数不一致的可能原因:
浓盐酸具有挥发性,长期放置质量分数减小
浓盐酸具有挥发性,长期放置质量分数减小
.分析:仔细阅读材料后,发现是围绕着金属钠的化学性质进行探究与分析,由于钠是一种化学性质非常活泼的金属,因此就表现出一些特殊性质,同学们要抛却思维定势,从资料查阅和实验现象入手大胆分析猜想,从而得出正确答案.
[拓展应用]①正确书写化学方程式.
②盐酸与氢氧化钠恰好反应时,PH=7有图象知道此时盐酸溶液的质量是25g,再利用氢氧化钠的质量利用化学方程式的计算盐酸的溶质质量分数.
③浓盐酸易挥发,放置时间过长会使自身溶质质量分数减小.
[拓展应用]①正确书写化学方程式.
②盐酸与氢氧化钠恰好反应时,PH=7有图象知道此时盐酸溶液的质量是25g,再利用氢氧化钠的质量利用化学方程式的计算盐酸的溶质质量分数.
③浓盐酸易挥发,放置时间过长会使自身溶质质量分数减小.
解答:解:(1)常温下,钠极易与氧气反应生成白色固体氧化钠,所以要保存在煤油中.答案为:钠易与氧气反应;
(2)金属钠可以与水剧烈反应放出氢气,可以理解为钠置换出水中的氢,把水看做HOH就比较好理解了.答案为:2Na+2H2O═2NaOH+H2↑;2Na+2H2O+CuSO4=H2↑+Cu(OH)2↓+Na2SO4
剩余固体加热到更高温度固体的质量又会减少,根据氧化铜中所含的两种元素可猜想可能是氧化铜中的氧元素转化为氧气,根据计算会发现氧化铜中氧元素的质量大于固体减少的质量,那么就可能是氧化铜中的部分氧元素转化为氧气.氧化铜加热后质量又会减少,应该是氧化铜中的氧元素转化为氧气,24g氧化铜的氧元素的质量=24g×
=4.8g,大于2.4g,说明是氧化铜中的部分氧元素转化为氧气.故答案为:4CuO
2Cu2O+O2↑.
(3)钠在CO2中燃烧后瓶内附着黑色颗粒,从反应物的元素组成来分析,黑色颗粒只能是碳,而白色物质可能是氧化钠或碳酸钠或二者的混合物,但不能是氢氧化钠,因为反应物中没有氢元素.氧化钠和水反应生成氢氧化钠,所以其水溶液呈碱性,碳酸钠溶液也呈碱性,鉴别它们时不能只用酚酞,要鉴别碳酸根离子,
故答案为:碳 ①反应物中没有氢元素,②碳酸钠 B 乙
③碳酸钠溶液和氢氧化钠溶液都呈碱性,故用酚酞不能鉴别,金属钠与水反应放出氢气,也能和二氧化碳反应,故金属钠着火时不能有水和二氧化碳灭火器,最好是用黄沙掩埋.
答案为:碳酸钠溶液也是碱性的,用黄沙掩埋.
[拓展应用]①正确书写化学方程式HCl+NaOH=NaCl+H2O;②
设该盐酸的实际质量分数为x、
HCl+NaOH=NaCl+H2O
36.5 40
25g x 20g×40%
=
解得x=29.2%
答:该盐酸的实际质量分数是29.2%.
③浓盐酸易挥发,放置时间过长会使因会发出氯化氢气体而使自身溶质质量分数减小.
故答案为:浓盐酸具有挥发性,长期放置质量分数减小.
故答案为:[问题讨论](1)钠易与氧气反应
(2)2Na+2H2O═2NaOH+H2↑; 2Na+2H2O+CuSO4=H2↑+Cu(OH)2↓+Na2SO4.4CuO
2Cu2O+O2↑.
(3)C,①反应物中没有氢元素.②方案2:碳酸钠.方案3:B,乙.
③评价与反思:碳酸钠溶液也是碱性的;用黄沙掩埋.
[拓展应用]①HCl+NaOH=NaCl+H2O.②29.2%.③浓盐酸具有挥发性,长期放置质量分数减小.
(2)金属钠可以与水剧烈反应放出氢气,可以理解为钠置换出水中的氢,把水看做HOH就比较好理解了.答案为:2Na+2H2O═2NaOH+H2↑;2Na+2H2O+CuSO4=H2↑+Cu(OH)2↓+Na2SO4
剩余固体加热到更高温度固体的质量又会减少,根据氧化铜中所含的两种元素可猜想可能是氧化铜中的氧元素转化为氧气,根据计算会发现氧化铜中氧元素的质量大于固体减少的质量,那么就可能是氧化铜中的部分氧元素转化为氧气.氧化铜加热后质量又会减少,应该是氧化铜中的氧元素转化为氧气,24g氧化铜的氧元素的质量=24g×
| 16 |
| 80 |
| ||
(3)钠在CO2中燃烧后瓶内附着黑色颗粒,从反应物的元素组成来分析,黑色颗粒只能是碳,而白色物质可能是氧化钠或碳酸钠或二者的混合物,但不能是氢氧化钠,因为反应物中没有氢元素.氧化钠和水反应生成氢氧化钠,所以其水溶液呈碱性,碳酸钠溶液也呈碱性,鉴别它们时不能只用酚酞,要鉴别碳酸根离子,
故答案为:碳 ①反应物中没有氢元素,②碳酸钠 B 乙
③碳酸钠溶液和氢氧化钠溶液都呈碱性,故用酚酞不能鉴别,金属钠与水反应放出氢气,也能和二氧化碳反应,故金属钠着火时不能有水和二氧化碳灭火器,最好是用黄沙掩埋.
答案为:碳酸钠溶液也是碱性的,用黄沙掩埋.
[拓展应用]①正确书写化学方程式HCl+NaOH=NaCl+H2O;②
设该盐酸的实际质量分数为x、
HCl+NaOH=NaCl+H2O
36.5 40
25g x 20g×40%
| 36.5 |
| 25gx |
| 40 |
| 20g×40% |
答:该盐酸的实际质量分数是29.2%.
③浓盐酸易挥发,放置时间过长会使因会发出氯化氢气体而使自身溶质质量分数减小.
故答案为:浓盐酸具有挥发性,长期放置质量分数减小.
故答案为:[问题讨论](1)钠易与氧气反应
(2)2Na+2H2O═2NaOH+H2↑; 2Na+2H2O+CuSO4=H2↑+Cu(OH)2↓+Na2SO4.4CuO
| ||
(3)C,①反应物中没有氢元素.②方案2:碳酸钠.方案3:B,乙.
③评价与反思:碳酸钠溶液也是碱性的;用黄沙掩埋.
[拓展应用]①HCl+NaOH=NaCl+H2O.②29.2%.③浓盐酸具有挥发性,长期放置质量分数减小.
点评:本题在同学们原有的知识基础上,进一步对钠的性质进行探究,既培养了同学们的分析能力,又与高中知识进行接轨.在解此类题时,首先要将题中的知识认知透,然后结合学过的知识进行解答,此类题难度较大,要细心进行分析解答.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
 20、通过“金属和金属材料”和“燃烧”的复习,同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题:
20、通过“金属和金属材料”和“燃烧”的复习,同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题: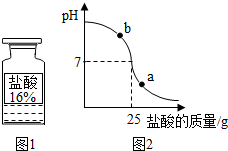 (2013?高淳县二模)学习化学一年后,同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题:
(2013?高淳县二模)学习化学一年后,同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题: 学习化学一年后,同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题:
学习化学一年后,同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题: