网址:http://m.1010jiajiao.com/timu_id_58055[举报]
一.选择题(本题包括9小题,每小题3分,共27分。每小题只有一个选项符合题意)
1.B解析:由于H2在O2中燃烧是放热反应,因此水的分解反应一定是吸热反应。
2.C解析:由图示可知甲中所盛试剂用于吸收混合气中的CO2,可排除A、D两选项;丙中所盛试剂用于干燥CO和CO2两气体,排除B选项。
3.D解析:本题以表格的形式考查温度、浓度对化学反应速率的影响等,这是《考试大纲》规定应“理解”的知识点,考核考生通过图表获取信息的能力。解答过程为:在反应物浓度相同时,温度越高化学反应速率愈大;在温度相同时,反应物浓度越高,化学反应速率愈大。
4.A解析:CH3COONa溶液中存在CH3COO- + H2O.files\image038.gif) CH3COOH
+ OH-的水解平衡,加入的NH4NO3和FeCl2显酸性,故促进其平衡正向移动,则CH3COO-浓度减小;加入的Na2SO3水解显碱性,对其平衡有抑制,故CH3COO- 浓度增大。
CH3COOH
+ OH-的水解平衡,加入的NH4NO3和FeCl2显酸性,故促进其平衡正向移动,则CH3COO-浓度减小;加入的Na2SO3水解显碱性,对其平衡有抑制,故CH3COO- 浓度增大。
5、A解析:原电池反应必须是自发的氧化还原反应。A选项中的反应不是氧化还原反应。
6、D解析:足量Cl2通入溴化亚铁溶液中,Cl2不但氧化Fe2+,还能氧化Br-,故A错误;B项中电荷不守恒;C项不符合反应事实,Cu2+将Fe氧化为Fe2+。
7、D解析:由图可知4mol单质Y和足量盐酸反应产生
8、C解析:由题给图示可知三聚氰胺的分子式为C3N6H6,一是分子中含有氮原子不可能为烃。
9、B解析:植物油是碳氢氧化合物,故A错;乙醇可以被氧化为乙酸,二者都能发生酯化反应,B对 ;乙烯和苯在工业上都不能通过石油分馏得到,所以C错;含5个碳原子的环状烷就烃含5个C-C单键,故D错。
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。若正确答案包括两个选项,只选一个且正确得2分,但只要选错一个就得0分)
10、D解析:由图示可知随Cl2、FeI2的物质的量比增加,当Cl2、FeI2比值小于1仅发生的反应为2I-+Cl2==I2+2Cl-,当Cl2、FeI2比值在1和1.5之间时,2I-+Cl2==I2+2Cl-完全反应,2Fe2++Cl2==2Fe3++2Cl-部分反应,当Cl2、FeI2比值在1.5和6.5之间时,仅发生反应I2+5Cl2+6H2O=2HIO3+10HCl。由于碘酸和盐酸均为强酸,最终溶液呈强酸性溶液的pH减小。
11、B解析:金属元素的化合价一定是正价,因而其原子只有还原性,但其离子不一定只有氧化性,如Fe2+就有还原性,汞在常温下为液态。
12、AC解析:18O为8质子10中子原子,故1 mol 18O2所含质子数为16 mol,即16NA;.files\image040.gif) 在与NaOH充分反应后转化为Na
在与NaOH充分反应后转化为Na.files\image042.gif) O2,即1
mol Al可失去3
mol电子,故0.5 mol Al可失去的电子数为1.5NA;在标准状况下SO3为固体,
O2,即1
mol Al可失去3
mol电子,故0.5 mol Al可失去的电子数为1.5NA;在标准状况下SO3为固体,
13、D解析:本题易误选B,c元素为硅,硅形成的化合物与碳相似,除了同学们熟悉的甲硅烷(SiH4)外,还有一系列不稳定的化合物硅烷(SinH2n+2)等。
14、BD解析:原电池的正极发生还原反应,负极发生氧化反应。这里的燃料电池电极反应为:负极:CH4+10OH--8e-==CO32-+7H2O正极:O2+2H2O+4e-==4OH-由此可见A、C正确。由正极的电极反应可知,O2~4e-,所以
15、AB解析:本题考查了等效平衡和平和平衡移动原理,侧重于考查分析解决问题的能力。当加入2molC时,将它全部转化为反应物时,得到A、B的物质的量之比为2:1,这样相当于少加了B,则A的转化率减小,体积分数增大,A正确;因氦不参加反应,所以当加入2mol A、1mol B和1molHe时,相当于只加了2molA和1molB,同A,B正确;同样分析出C、D均不正确。
16、CD解析:因为草酸氢钾呈酸性,所以HC2O4-电离程度大于水解程度,故c(C2O42-)>c(H
17、AC分析:HCl溶于水完全电离,而CH3COOH溶于水存在电离平衡:CH3COOH.files\image043.jpg) CH3COO-+H+,加水该平衡向右移动,H+物质的量增大,需加更多的水才能与盐酸c(H+)相同;加CH3COONa时,c(CH3COO-)增大,上述平衡向左移动。c(H+)降低,pH变大,而盐酸加NaCl后pH基本不变。故A、C符合题意。B只能说明盐酸和醋酸具有挥发性,D只说明c(H+)相同,速率相同,与醋酸是否完全电离均无关,故B、D不符合题意。
CH3COO-+H+,加水该平衡向右移动,H+物质的量增大,需加更多的水才能与盐酸c(H+)相同;加CH3COONa时,c(CH3COO-)增大,上述平衡向左移动。c(H+)降低,pH变大,而盐酸加NaCl后pH基本不变。故A、C符合题意。B只能说明盐酸和醋酸具有挥发性,D只说明c(H+)相同,速率相同,与醋酸是否完全电离均无关,故B、D不符合题意。
18、C解析:本题考查对转化率概念的理解与运用。由转化率求产物的量,要注意到反应所需的酸也来源于醇,因此,在计算醇转化为酯的总转化率时是要考虑醇的上述消耗。设有xmol乙醇,则可产生xamol乙醛,进而产生xabmol乙酸,另取xabmol乙醇与xabmol乙酸转化为酯,同时xabmol乙酸中也有xabcmol转化为酯,从源头上说,这些酸也是醇一步步氧化得来的。故当有(x+xab)mol乙醇转化为乙酸乙酯时,共有2xabc乙醇发生了转化,转化率应为.files\image045.gif) =
=.files\image018.gif) 。
。
三、本题包括3小题,共34分)
19、(11分)(1)CO32-+ H2O.files\image048.jpg) HCO3-+OH-(2分)(配平、化学式错得0分,写等号扣1分)(2)不再有气泡产生(或只有极少量气泡产生)(1分)(3)若控制不准确温度过高Fe2+易被氧化;由于有氢气生成,明火加热不安全 (2分,两个方面各占1分)(4)4Fe2+ + O2 + 4H+ = 4Fe3+ + 2H2O(2分,化学式错得0分,配平错扣1分)(5)6.6(2分,多写单位g不扣分)(6)循环使用(2分,具体说出如何循环使用同样得分,意思相近表达欠清晰扣1分)
HCO3-+OH-(2分)(配平、化学式错得0分,写等号扣1分)(2)不再有气泡产生(或只有极少量气泡产生)(1分)(3)若控制不准确温度过高Fe2+易被氧化;由于有氢气生成,明火加热不安全 (2分,两个方面各占1分)(4)4Fe2+ + O2 + 4H+ = 4Fe3+ + 2H2O(2分,化学式错得0分,配平错扣1分)(5)6.6(2分,多写单位g不扣分)(6)循环使用(2分,具体说出如何循环使用同样得分,意思相近表达欠清晰扣1分)
20、(11分)(1)假设2:溶液中存在CO32-和HCO3-(2分)假设3、溶液中存在CO32-和SO42-(2和3顺序不限。)(2分)
(2)①用胶头滴管取少量溶液加入试管中,再用滴管取过量的1mol/L氯化钡溶液并滴加到试管A中,充分反应后,静置,然后过滤,将沉淀和滤液分别装入另外的两个试管中(2分);产生白色沉淀。②往装有沉淀的试管中加入过量的2mol/L盐酸;沉淀不溶解,说明原溶液中一定含有SO42-而无CO32-。③往装有滤液的试管中加入2mol/L盐酸;出现无色气泡,说明原溶液中含有HCO3-。(除标明分数的以外,每空各1分。)
21、(12分)(1)11.76~11.78均得分(1分)(2)Na2CO3
和NaHCO3 (2分)因为第一滴定终点所用体积小于第二滴定终点所用体积或V1<(V2-V1)或计算说明 (2分)(3)以防滴定过快使Na2CO3直接生成H2CO3 (2分)(4)碱样的总碱量为:n(Na2O)= [(25.02mL +24.98 mL)/2]×10
四、(本题包括3小题,共34分)
22、(11分)步骤一:正 (1分)。 Cu2++2e = Cu (1分);变小(1分) 3Ag + 4H+ + NO3―=3Ag+ + NO ↑+ 2H2O(2分) 浓盐酸含有大量氯离子,Au3+ 离子与氯离子形成稳定的AuCl4―离子,使反应2平衡向右移动,则金溶于王水中。(2分)0.5 (2分), 0.1(2分)23、(11分)(1)强氧化性(漂白性)(2分)(2)a、b、c(各1分,全对给3分,选有d不给分)(3)降低2 Na2CO3?3H2O2的溶解度(1分),析出更多晶体(1分)(4)催化双氧水的分解(1分)(5)温度高时双氧水易分解(1分),温度低时反应缓慢(1分)(6)晶体的洗涤(2分)
24、(12分)Ⅰ(1)洗去铝表面的油污(2分), A l2O3+2OH―+3H2O=2Al(OH)4―或A l2O3+2OH―=2AlO2―+H2O(2分)(2)
五、(本题包括1小题,9分)
25、(9分)(1)②(1分);酸性KMnO4会氧化C6H5―NH2生成焦油状的复杂物质(1分)
.files\image050.jpg) (2)HOOC- 《 -NO2(2分)
(2)HOOC- 《 -NO2(2分)
(3)聚合(缩聚);加成(1分)
(4)C6H5-CH2Cl+NaOH->C6H5-CH20H+NaCl(2分)
.files\image052.jpg)
(2分)
六、选择题(本题包括2小题,每小题10分,考生只能选做一题。26小题为“有机化学基础”内容的试题,27小题为“物质结构与性质”内容的试题)
26、(10分)(1)C5H10O(2分)(2)HOOC―CH2―COOH
+ .files\image053.gif) C2H5OOC―CH2―COOC2H5
+2H2O;(2分)酯化反应(或取代反应)(1分)(3)HO―CH2―CH2―CH=CH―CH3(2分)(4)2;(1分)CH3CH2CH2COOH、CH3CH(CH3)COOH(2分)
C2H5OOC―CH2―COOC2H5
+2H2O;(2分)酯化反应(或取代反应)(1分)(3)HO―CH2―CH2―CH=CH―CH3(2分)(4)2;(1分)CH3CH2CH2COOH、CH3CH(CH3)COOH(2分)
27、(10分) (1)1s22s22p63s23p6 (1分)(2)ZCl<Ycl<XCl (1分) (3) Cu 4 (每空2分,共4分)(4) CH3―CH2―Cl中与Cl原子成键的C以sp3杂化,而CH2=CH2―Cl中与Cl原子成键的C以sp2杂化,电子云密度不同;CH3―CH2―Cl中的C―Cl的键长比CH2=CH2―Cl中C―Cl要长;CH2=CH2―Cl的∏键对Cl的作用力比CH3―CH2―Cl的a键强。(答对两点给2分)(5)HF沸点比HCl高;氢氟酸是弱酸,盐酸是强酸;实验测得HF分子质量偏大。(答对两点给2分)
(1)在Al2O3、Ni催化下气态甲酸发生下列反应:
甲酸(g)=CO (g)+H2O (g)△H1=+34.0kJ/mol
甲酸(g)=CO2 (g)+H2(g)△H2=-7.0kJ/mol
在该条件下,气态CO2 和气态H2 生成气态CO和气态H2O的热化学方程式为
(2)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水(H2O2).当把0.4mol液态肼和0.8mol 液态H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101kPa下测得的热量).反应的热化学方程式为
(3)已知:C(s)+O2(g)=CO2(g)△H=-393.5kJ?mol-1
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1
现有0.2mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中C与H2的物质的量之比为
(1)将等质量的Zn粉分别投入:试管A:10mL 0.1mol?L-1 HCl和试管B:10mL 0.1mol?L-1醋酸中:开始时,反应速率A
(2)将等质量Zn粉分别投入pH=1体积均为10mL的试管A:盐酸和试管B:醋酸中:开始时,反应速率A
(3)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈
(4)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈
(5)氯化铝水溶液呈
(6)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的
(1)用甲烷制备一氯甲烷的化学方程式是
| 光照 |
| 光照 |
(2)用乙烯制备氯乙烷的化学方程式是
(1)常温下,pH=5的盐酸和pH=9的氢氧化钠溶液按体积比9:11混合,混合后溶液的pH为
(2)NH4Cl溶液显酸性,试用离子方程式表示这一反应
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+(3)已知水的电离方程式可写为2H2O?H3O++OH-,液氨类似于水的电离,试写出液氨的电离方程式
 NH4++NH2-
NH4++NH2- NH4++NH2-
NH4++NH2-(4)pH相同的氨水和氢氧化钠溶液,分别用蒸馏水稀释至原来体积的m倍和n倍,稀释后两溶液的pH仍相同,则m
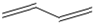

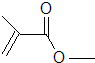 的结构简式
的结构简式 的分子式为
的分子式为