题目内容
回答下列问题:
(1)常温下,pH=5的盐酸和pH=9的氢氧化钠溶液按体积比9:11混合,混合后溶液的pH为
(2)NH4Cl溶液显酸性,试用离子方程式表示这一反应
(3)已知水的电离方程式可写为2H2O?H3O++OH-,液氨类似于水的电离,试写出液氨的电离方程式
(4)pH相同的氨水和氢氧化钠溶液,分别用蒸馏水稀释至原来体积的m倍和n倍,稀释后两溶液的pH仍相同,则m
(1)常温下,pH=5的盐酸和pH=9的氢氧化钠溶液按体积比9:11混合,混合后溶液的pH为
8
8
(2)NH4Cl溶液显酸性,试用离子方程式表示这一反应
H2O+NH4+ NH3?H2O+H+
NH3?H2O+H+
 NH3?H2O+H+
NH3?H2O+H+H2O+NH4+ NH3?H2O+H+
NH3?H2O+H+
. NH3?H2O+H+
NH3?H2O+H+(3)已知水的电离方程式可写为2H2O?H3O++OH-,液氨类似于水的电离,试写出液氨的电离方程式
2NH3 NH4++NH2-
NH4++NH2-
 NH4++NH2-
NH4++NH2-2NH3 NH4++NH2-
NH4++NH2-
;在液氨中加入NH4Cl,则平衡将向 NH4++NH2-
NH4++NH2-逆反应方向
逆反应方向
移动(填“正反应方向”或“逆反应方向”).(4)pH相同的氨水和氢氧化钠溶液,分别用蒸馏水稀释至原来体积的m倍和n倍,稀释后两溶液的pH仍相同,则m
>
>
n(选填“>”、“<”或“=”);若改用pH相同的盐酸和硫酸溶液,进行上述操作,则m=
=
n(选填“>”、“<”或“=”).分析:(1)pH=5的盐酸中c(H+)=10-5mol/L,pH=9的氢氧化钠溶液中c(OH-)=10-5mol/L,首先判断酸碱的过量问题,计算反应后的c(H+)或c(OH-),进而计算混合后的pH;
(2)NH4Cl为强酸弱碱盐,水解呈酸性;
(3)根据水的电离和题给信息结合外界条件对平衡移动的影响分析;
(4)pH相同的氨水和氢氧化钠溶液,氨水的浓度大,以稀释同体积为参考进行比较;盐酸和硫酸都是强电解质,溶液pH相同的,则c(H+)相同.
(2)NH4Cl为强酸弱碱盐,水解呈酸性;
(3)根据水的电离和题给信息结合外界条件对平衡移动的影响分析;
(4)pH相同的氨水和氢氧化钠溶液,氨水的浓度大,以稀释同体积为参考进行比较;盐酸和硫酸都是强电解质,溶液pH相同的,则c(H+)相同.
解答:解:(1)pH=5的盐酸中c(H+)=10-5mol/L,pH=9的氢氧化钠溶液中c(OH-)=10-5mol/L,按体积比9:11混合,则NaOH过量,反应后c(OH-)=
=10-6mol/L,则pH=8,故答案为:8;
(2)NH4Cl为强酸弱碱盐,在溶液中发生H2O+NH4+ NH3?H2O+H+,水解呈酸性,
NH3?H2O+H+,水解呈酸性,
故答案为:H2O+NH4+ NH3?H2O+H+;
NH3?H2O+H+;
(3)液氨类似于水的电离,已知水的电离方程式可写为2H2O?H3O++OH-,则液氨的电离方程式为2NH3 NH4++NH2-,在液氨中加入NH4Cl,NH4+浓度增大,则平衡向逆反应方向移动,
NH4++NH2-,在液氨中加入NH4Cl,NH4+浓度增大,则平衡向逆反应方向移动,
故答案为:2NH3 NH4++NH2-;逆反应方向;
NH4++NH2-;逆反应方向;
(4)pH相同的氨水和氢氧化钠溶液,氨水的浓度大,如稀释相同体积,则氨水溶液pH较大,而稀释后相等,则氨水加入水应较多,即m>n,盐酸和硫酸都是强电解质,溶液pH相同的,则c(H+)相同,如稀释后pH仍相同,则稀释倍数应相同,即m=n,
故答案为:>;=.
| 11VL×10-5mol/L-9VL×10-5mol/L |
| 11VL+9VL |
(2)NH4Cl为强酸弱碱盐,在溶液中发生H2O+NH4+
 NH3?H2O+H+,水解呈酸性,
NH3?H2O+H+,水解呈酸性,故答案为:H2O+NH4+
 NH3?H2O+H+;
NH3?H2O+H+;(3)液氨类似于水的电离,已知水的电离方程式可写为2H2O?H3O++OH-,则液氨的电离方程式为2NH3
 NH4++NH2-,在液氨中加入NH4Cl,NH4+浓度增大,则平衡向逆反应方向移动,
NH4++NH2-,在液氨中加入NH4Cl,NH4+浓度增大,则平衡向逆反应方向移动,故答案为:2NH3
 NH4++NH2-;逆反应方向;
NH4++NH2-;逆反应方向;(4)pH相同的氨水和氢氧化钠溶液,氨水的浓度大,如稀释相同体积,则氨水溶液pH较大,而稀释后相等,则氨水加入水应较多,即m>n,盐酸和硫酸都是强电解质,溶液pH相同的,则c(H+)相同,如稀释后pH仍相同,则稀释倍数应相同,即m=n,
故答案为:>;=.
点评:本题考查较为综合,涉及酸碱混合的计算、盐类的水解、弱电解质的电离等知识,题目难度中等,注意把握弱电解质的电离特点以及影响因素.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
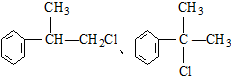
 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成


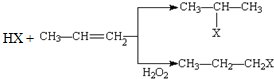 (X为卤素原子)
(X为卤素原子)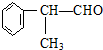 的物质,该物质是一种香料.
的物质,该物质是一种香料.