网址:http://m.1010jiajiao.com/timu_id_57827[举报]
题号
14
15
16
17
18
19
20
21
答案
A
AC
D
C
B
B
BC
CD
22.(Ⅰ) (1)甲 (2)BC (3)2.0 1.50 1.0
(Ⅱ) (1)0.25 (2)小车滑行时所受摩擦阻力较大 (3)使导轨倾斜一定的角度以平衡摩擦力
 23.解:⑴由题意可知:小球落到斜面上并沿斜面下滑,说明此时小球速度方向与斜面平行,否则小球会弹起,所以υy = υ0tan53° (2分) υy2 = 2gh
(2分)
23.解:⑴由题意可知:小球落到斜面上并沿斜面下滑,说明此时小球速度方向与斜面平行,否则小球会弹起,所以υy = υ0tan53° (2分) υy2 = 2gh
(2分)
代入数据,得υy =
⑵由υy = gt1得t1 = 0.4s (1分)
s =υ0t1 = 3×
⑶小球沿斜面做匀加速直线运动的加速度a = (1分)
初速度 =
=υt2
+ a
t22 (2分)
代入数据,整理得
4t22 + 5t2 - 26 = 0
解得 t2 =
2s 或t2 = - 13s(不合题意舍去)
(1分)
所以t =
t1 + t2 = 2.4s (1分)
24.(1)小球在C处受水平向右的电场力F和竖直向下的重力G,加速度为 g
g
则由 (3分)
(3分)
(2)从A→B由动能定理得  (3分)
(3分)  (1分)
(1分)
在B点,由牛顿运动定律得: (2分) 得
(2分) 得 (1分)
(1分)
(3) 小球从B点穿出后,在电场和重力场的复合场中做类平抛运动,由运动分解知识得:
水平方向:

 (3分)
(3分)
竖直方向: (1分) 联立解得:s=R/2
(1分) 联立解得:s=R/2  (2分)
(2分)
 由题意得: 虚线框MNPQ的高度h≥sBC+R=
由题意得: 虚线框MNPQ的高度h≥sBC+R= 宽度L≥2R (1分)
宽度L≥2R (1分)
30.A.解析:设月球表面重力加速度为g,月球质量为M.
∵球刚好完成圆周运动,∴小球在最高点有 (4分)
(4分)
从最低点至最高低点有  (4分)
(4分)
由①②可得 (3分)
(3分)
∵在月球表面发射卫星的最小速度为月球第一宇宙速度
∴ (4分)
(4分)
B.解: (1)设滑块到达B点的速度为v,由机械能守恒定律,有
 .--------4分
.--------4分
(2)滑块在传送带上做匀加速运动,受到传送带对它的滑动摩擦力,有 mg =ma,滑块对地位移为L,末速度为v0,则
mg =ma,滑块对地位移为L,末速度为v0,则 ,得
,得 --------------4分
--------------4分
(3)产生的热量等于滑块与传送带之间发生的相对位移中克服摩擦力所做的功,即
 为带与滑块间的相对位移,设所用时间为t,则
为带与滑块间的相对位移,设所用时间为t,则 , 3分
, 3分
得 。-----------4分
。-----------4分
C.解:(1)设乙物体运动到最高点时,绳子上的弹力为T1,
对乙物体  =5N
(2分)
=5N
(2分)
当乙物体运动到最低点时,绳子上的弹力为T2
对乙物体由机械能守恒定律:  (3分)
(3分)
又由牛顿第二定律: 
 (2分)
(2分)
得: =20N
(2分)
=20N
(2分)
(2)设甲物体的质量为M,所受的最大静摩擦力为f ,
乙在最高点时甲物体恰好不下滑,有: (2分)
(2分)
乙在最低点时甲物体恰好不上滑,有:  (2分)
(2分)
可解得:  (1分)
(1分)
 (1分)
(1分)
D. 解:(1)在电荷由A移到B的过程中,电势能增加了0.1J,所以电场力做功-0.1J
(2)由U=W/q,U=-0.1J/-2×10
(3)由E=U/d=U/ABCOS60O=5×105 (V/m)
I.(1)从废干电池中提取NH4Cl.
①利用该糊状物提取NH4Cl前两步的操作为:a.溶解 b.
②甲同学设想:将分离出的NH4Cl溶液蒸发、结晶、灼烧,就可以制得纯净的NH4Cl.
请对甲同学的方案作出评价并说明理由:
(2)制取氨气.
①乙同学要制备并收集到纯净的氨气,下列各反应及操作中合理的是
a.将氯化铵固体加热分解 b.将浓氨水滴入氢氧化钠固体中
c.将氢氧化钠固体加入浓氨水中 d.将氯化铵浓溶液滴入氢氧化钠固体中
②乙同学认为将集气瓶正放在桌上(如图1所示),就可以收集到纯净的氨气.
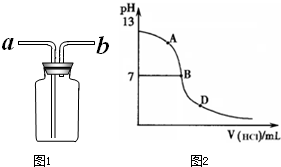
你若认为可行,请说明其操作:
你若认为不可行,请说明其理由:
Ⅱ.丙同学利用上面得到的氨气制取氨水并进行了如下探究实验:
(3)为探究NH3?H2O是否是弱电解质.
丙该同学设计方案如下:①将1.12L(标况)NH3完全溶于水,配得溶液500mL;②
请把最简单的实验步骤②,填写在上面的空格中.
(4)探究氨水与盐酸的反应过程.
丙同学进行了如下实验:向25mL上述氨水中逐滴滴加同浓度的盐酸,测定反应过程中溶液pH并绘制其pH变化曲线(如图2).请回答:
①酸碱恰好完全中和时的pH点应是
 (2008?山东)苯丙酸诺龙是一种兴奋剂,结构简式为:
(2008?山东)苯丙酸诺龙是一种兴奋剂,结构简式为:(I)(1)由苯丙酸诺龙的结构推测,它能
a.使溴的四氯化碳溶液褪色 b.使酸性KMnO4溶液褪色
c.与银氨溶液发生银镜反应 d.与Na2CO3溶液作用生成CO2
(II)苯丙酸诺龙的一种同分异构体A,在一定条件下可发生下列反应:

提示:已知反应R-CH2-COOH+Cl2
| 红磷 |
| C | ||
|
据以上信息回答(2)~(4)题:
(2)B→D的反应类型是
(3)C的结构简式为


(4)F→G的化学方程式是


A.不慎将酸溅到眼中,立即用水冲洗,边洗边眨眼睛
B.酒精灯洒漏少量酒精着火,用湿布盖灭
C.实验剩余的NaOH放回原试剂瓶
D.在容量瓶中加入一定体积的水再加入浓硫酸,配置准确浓度的稀硫酸
E.知趣乙酸乙酯时,加热前应先向试管中加入碎瓷片
II、无水氯化铝为白色粉末,极易吸水,常压下182.7℃升华.学生甲拟选用如图所示仪器、装置(部分仪器连接的橡胶管或橡胶塞省略)和试剂制备无水氯化铝.
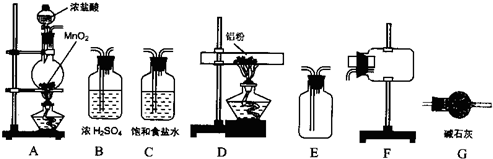
回答下列问题
(2)实验前,如何检查装置A的气密性
(3)装置A中反应的化学方程式为
| ||
| ||
(4)从上列仪器中选取制备无水氯化铝的装置,各装置的连接顺序为:
A→
(5)装置G的作用是
(6)学生乙提出另一种制备无水氯化铝的方案:将金属铝与足量盐酸反应后,将溶液加热蒸干、灼烧的到无水氯化铝.请你评价该方案是否可行,并说明理由
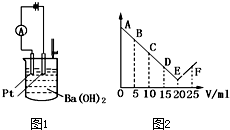 如图1所示:将30ml 0.1mol?L-1Ba(OH)2溶液置于烧杯中,然后慢慢加入0.1mol?L-1某第三周期元素形成的某酸溶液共25mL,加入酸溶液的体积V与电流强度I的I-V图如图2所示.
如图1所示:将30ml 0.1mol?L-1Ba(OH)2溶液置于烧杯中,然后慢慢加入0.1mol?L-1某第三周期元素形成的某酸溶液共25mL,加入酸溶液的体积V与电流强度I的I-V图如图2所示.(1)此酸的化学式为
(2)处于C点时溶液中导电的阳离子主要是
(3)处于F点时,溶液中导电的阴离子主要是
(4)烧杯中刚加入酸时,观察到的现象是
(5)从A→E电流强度I变小的主要原因是
(2)配制样品溶液时,不一定需要的实验仪器是
A、容量瓶B、玻璃棒 C、滴定管
(3)滴定管在注入酸性高锰酸钾溶液之前,先用蒸馏水洗净,再用
(4)滴定终点的现象是
(5)滴定至终点消耗高锰酸钾溶液的体积为V2 mL,则原样品中Na2SO4的质量分数为
Ⅱ.FeCO3是白色沉淀,已知Ksp(FeCO3)=2×10-11,将FeCl2稀溶液与Na2CO3溶液等体积混合,若原FeCl2溶液的浓度为2×10-5 mol/L,则生成沉淀所需Na2CO3溶液最小浓度为