题目内容
某学习兴趣小组探究废干电池(锌筒内填有炭粉、MnO2、NH4Cl等的糊状物)的回收利用,并用回收的物质进行如下实验.I.(1)从废干电池中提取NH4Cl.
①利用该糊状物提取NH4Cl前两步的操作为:a.溶解 b.
②甲同学设想:将分离出的NH4Cl溶液蒸发、结晶、灼烧,就可以制得纯净的NH4Cl.
请对甲同学的方案作出评价并说明理由:
(2)制取氨气.
①乙同学要制备并收集到纯净的氨气,下列各反应及操作中合理的是
a.将氯化铵固体加热分解 b.将浓氨水滴入氢氧化钠固体中
c.将氢氧化钠固体加入浓氨水中 d.将氯化铵浓溶液滴入氢氧化钠固体中
②乙同学认为将集气瓶正放在桌上(如图1所示),就可以收集到纯净的氨气.
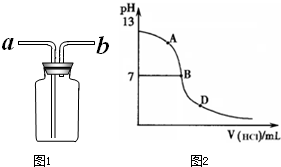
你若认为可行,请说明其操作:
你若认为不可行,请说明其理由:
Ⅱ.丙同学利用上面得到的氨气制取氨水并进行了如下探究实验:
(3)为探究NH3?H2O是否是弱电解质.
丙该同学设计方案如下:①将1.12L(标况)NH3完全溶于水,配得溶液500mL;②
请把最简单的实验步骤②,填写在上面的空格中.
(4)探究氨水与盐酸的反应过程.
丙同学进行了如下实验:向25mL上述氨水中逐滴滴加同浓度的盐酸,测定反应过程中溶液pH并绘制其pH变化曲线(如图2).请回答:
①酸碱恰好完全中和时的pH点应是
分析:(1)①依据氯化铵溶于水,炭粉、MnO2不溶于水,分析分离方法;
②氯化铵受热易分解;
(2)①收集到纯净的氨气,生成的氨气中不能含有杂质分析;
②利用装置图可以收集到较纯净的氨气,氨气比空气轻,导气管短进长出收集;
(3)依据一水合氨溶液中存在电离平衡分析,测定溶液PH判断,溶液中氢氧根是否全部电离设计分析;
(4)①氨气和盐酸恰好反应生成氯化铵和水,氯化铵溶液中铵根离子水解显酸性,溶液PH小于7;
②恰好反应氨水是等浓度等体积混合,依据溶液中物料守恒分析计算得到c(NH3?H2O)+c(NH4+);
③氯化铵溶液中铵根离子水解显酸性,据此比较离子浓度大小.
②氯化铵受热易分解;
(2)①收集到纯净的氨气,生成的氨气中不能含有杂质分析;
②利用装置图可以收集到较纯净的氨气,氨气比空气轻,导气管短进长出收集;
(3)依据一水合氨溶液中存在电离平衡分析,测定溶液PH判断,溶液中氢氧根是否全部电离设计分析;
(4)①氨气和盐酸恰好反应生成氯化铵和水,氯化铵溶液中铵根离子水解显酸性,溶液PH小于7;
②恰好反应氨水是等浓度等体积混合,依据溶液中物料守恒分析计算得到c(NH3?H2O)+c(NH4+);
③氯化铵溶液中铵根离子水解显酸性,据此比较离子浓度大小.
解答:解:(1)①锌筒内填有炭粉、MnO2、NH4Cl等的糊状物,氯化铵溶于水,炭粉、MnO2不溶于水,可以溶解后过滤得到溶液,故答案为:过滤;
②分离出的NH4Cl溶液蒸发、结晶、灼烧,氯化铵易分解生成氨气和氯化氢,不能制得纯净的NH4Cl,故答案为:此方案不可行,原因是在灼烧时氯化铵会分解
(2)①a.将氯化铵固体加热分解生成氯化氢和氨气,不能得到纯净的氨气,故a不符合;
b.将浓氨水滴入氢氧化钠固体中,氢氧化钠溶解放热,使一水合氨分解生成氨气,故b符合;
c.将氢氧化钠固体加入浓氨水中,氢氧化钠固体溶解放出的热量被降低,同时氨气中带出大量水蒸气,故c不符合;
d.将氯化铵浓溶液滴入氢氧化钠固体中,生成的氨气少且易带出大量水蒸气,故d不符合;
故答案为:bd;
②利用装置图可以收集到较纯净的氨气,氨气比空气轻,导气管短进长出收集,故答案为:此方案可行,可从b管中通入氨气收集;
(3)将1.12L(标况)NH3完全溶于水,配得溶液500mL,溶液的浓度=
=1mol/L,通过测定溶液PH判断,若是强碱溶液PH=14,但测定溶液PH小于14,说明一水合氨溶液中存在电离平衡,证明是弱电解质,故答案为:测氨水的pH;
(4)①氨气和盐酸恰好反应生成氯化铵和水,氯化铵溶液中铵根离子水解显酸性,溶液PH小于7,所以酸碱恰好完全中和时的pH点应是D点,故答案为:D;
②恰好反应氨水是等浓度等体积混合,依据溶液中物料守恒分析计算得到c(NH3?H2O)+c(NH4+)=0.05mol/L,故答案为:0.05;
③氯化铵溶液中铵根离子水解显酸性,据此比较离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-).
②分离出的NH4Cl溶液蒸发、结晶、灼烧,氯化铵易分解生成氨气和氯化氢,不能制得纯净的NH4Cl,故答案为:此方案不可行,原因是在灼烧时氯化铵会分解
(2)①a.将氯化铵固体加热分解生成氯化氢和氨气,不能得到纯净的氨气,故a不符合;
b.将浓氨水滴入氢氧化钠固体中,氢氧化钠溶解放热,使一水合氨分解生成氨气,故b符合;
c.将氢氧化钠固体加入浓氨水中,氢氧化钠固体溶解放出的热量被降低,同时氨气中带出大量水蒸气,故c不符合;
d.将氯化铵浓溶液滴入氢氧化钠固体中,生成的氨气少且易带出大量水蒸气,故d不符合;
故答案为:bd;
②利用装置图可以收集到较纯净的氨气,氨气比空气轻,导气管短进长出收集,故答案为:此方案可行,可从b管中通入氨气收集;
(3)将1.12L(标况)NH3完全溶于水,配得溶液500mL,溶液的浓度=
| ||
| 0.5L |
(4)①氨气和盐酸恰好反应生成氯化铵和水,氯化铵溶液中铵根离子水解显酸性,溶液PH小于7,所以酸碱恰好完全中和时的pH点应是D点,故答案为:D;
②恰好反应氨水是等浓度等体积混合,依据溶液中物料守恒分析计算得到c(NH3?H2O)+c(NH4+)=0.05mol/L,故答案为:0.05;
③氯化铵溶液中铵根离子水解显酸性,据此比较离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-).
点评:本题考查了实验方案的分析判断,溶液中离子浓度大小比较,酸碱反应后溶液酸碱性的应用,物质性质和实验步骤的分析理解是解题关键,题目难度中等.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
Ⅰ.某化学兴趣小组探究饱和氯水与石灰石的反应,并制取较浓的HClO溶液和对所得溶液中的部分阴离子进行检验.
| 实验操作 | 实验现象 | |
| 步骤1 | 在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,过滤,将滤液分为若干份. | 有少量气泡产生,溶液的黄绿色褪去. |
| 步骤2 | 将第一份滤液与稀盐酸混合. | 产生大量气泡. |
| 步骤3 | 将第二份滤液加热. | 溶液变浑浊,且有大量无色气体产生. |
(2)步骤2、步骤3的实验目的都是______,为达到该实验目的,还可以采取的方法是______.
(3)请你设计-个简单的实验方案,证明步骤1所得滤液中的HClO浓度比饱和氯水中HClO浓度大:______.
Ⅱ.摩尔盐[(NH4)2SO4?FeSO4?6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组按以下步骤制取摩尔盐:
①用30%的NaOH溶液和废铁屑混合、煮沸、冷却、分离;
②用①处理过的铁屑和稀H2SO4反应制取FeSO4;
③将②制得的FeSO4溶液与[(NH4)2SO4溶液混合,结晶得到摩尔盐.
试回答下列问题:
(1)如何从溶液中分解出摩尔盐?
(2)如何设计一个简单的实验证明得到的产品中有Fe2+?
(3)为了确定产品中亚铁离子的含量,某研究小组用KMnO4酸性溶液进行滴定,请写出该反应的离子方程式:______.
(4)现有等浓度的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2溶液,其中c(NH4+)由大到小的顺序是:______(填序号).



 (4)探究氨水与盐酸的反应过程。
(4)探究氨水与盐酸的反应过程。