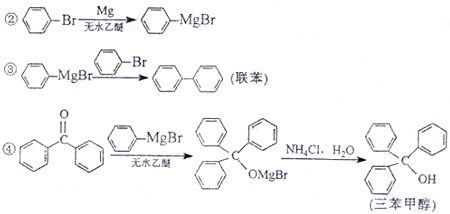
题目内容
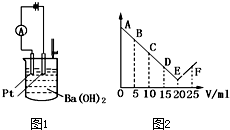 如图1所示:将30ml 0.1mol?L-1Ba(OH)2溶液置于烧杯中,然后慢慢加入0.1mol?L-1某第三周期元素形成的某酸溶液共25mL,加入酸溶液的体积V与电流强度I的I-V图如图2所示.
如图1所示:将30ml 0.1mol?L-1Ba(OH)2溶液置于烧杯中,然后慢慢加入0.1mol?L-1某第三周期元素形成的某酸溶液共25mL,加入酸溶液的体积V与电流强度I的I-V图如图2所示.(1)此酸的化学式为
H3PO4
H3PO4
; (2)处于C点时溶液中导电的阳离子主要是
Ba2+
Ba2+
;(3)处于F点时,溶液中导电的阴离子主要是
H2PO4-
H2PO4-
;(4)烧杯中刚加入酸时,观察到的现象是
有白色沉淀生成
有白色沉淀生成
;(5)从A→E电流强度I变小的主要原因是
生成难溶的Ba3(PO4)2和难电离的水,使溶液中的离子浓度降低
生成难溶的Ba3(PO4)2和难电离的水,使溶液中的离子浓度降低
.分析:(1)n(Ba(OH)2)=0.03L×0.1mol/L=0.003mol,n(酸)=0.1moL/L×0.02L=0.002mol,则可判断应为三元酸,即磷酸;
(2)在C点(加入磷酸的体积为10mL)时,烧杯中的Ba(OH)2还没有被完全中和;
(3)F时磷酸过量,溶液中存在的阴离子是H2PO4-;
(4)烧杯中刚加入酸时,1Ba(OH)2过量,生成沉淀;
(5)生成难溶于水的Ba3(PO4)2和难电离的水,离子浓度降低.
(2)在C点(加入磷酸的体积为10mL)时,烧杯中的Ba(OH)2还没有被完全中和;
(3)F时磷酸过量,溶液中存在的阴离子是H2PO4-;
(4)烧杯中刚加入酸时,1Ba(OH)2过量,生成沉淀;
(5)生成难溶于水的Ba3(PO4)2和难电离的水,离子浓度降低.
解答:解:(1)在第3周期元素中,能形成的酸可能是硅酸(H2SiO3,不溶于水)、磷酸(H3PO4,中强酸)、硫酸(H2SO4,二元强酸)、高氯酸(HClO4)、氯酸(HClO3)、次氯酸(HClO)、盐酸(HCl).根据已知条件“由第3周期某元素形成的某酸溶液”,可知该酸肯定不是硅酸(因为不溶于水).究竟是磷酸、硫酸,还是高氯酸等一元酸,这需要更进一步地分析.题中给出了酸、碱的浓度和体积,当两者恰好完全中和时,对应酸的体积与图2中E点的横坐标数值相符即可.对于硫酸来说,其中和反应的关系式是H2SO4~Ba(OH)2,恰好完全中和时,对应加入的硫酸的体积应为30mL,与图2中E点的横坐标值20不符,说明该酸不是硫酸.同理,可以推理得出该酸不是高氯酸等一元酸,只能是磷酸.具体的验证过程:发生中和反应的关系式为2H3PO4~3Ba(OH)2,得出需要磷酸的体积为20mL,与图2中E点的横坐标相符,所以,该酸是H3PO4,故答案为:H3PO4;
(2)在C点(加入磷酸的体积为10mL)时,烧杯中的Ba(OH)2还没有被完全中和,溶液中导电的阳离子主要是Ba2+,故答案为:Ba2+;
(3)F时磷酸过量,磷酸电离生成H2PO4-,故答案为:H2PO4-;
(4)在烧杯中刚加入磷酸时,发生的反应的化学方程式为2H3PO4+3Ba(OH)2=Ba3(PO4)2↓+6H2O,可以观察到的现象是溶液中产生白色沉淀,故答案为:有白色沉淀生成;
(5)图2中,从A→E电流强度I变小的主要原因是由于中和反应的发生,生成难溶于水的Ba3(PO4)2和难电离的水,使溶液中自由移动的离子浓度下降,
故答案为:生成难溶的Ba3(PO4)2和难电离的水,使溶液中的离子浓度降低.
(2)在C点(加入磷酸的体积为10mL)时,烧杯中的Ba(OH)2还没有被完全中和,溶液中导电的阳离子主要是Ba2+,故答案为:Ba2+;
(3)F时磷酸过量,磷酸电离生成H2PO4-,故答案为:H2PO4-;
(4)在烧杯中刚加入磷酸时,发生的反应的化学方程式为2H3PO4+3Ba(OH)2=Ba3(PO4)2↓+6H2O,可以观察到的现象是溶液中产生白色沉淀,故答案为:有白色沉淀生成;
(5)图2中,从A→E电流强度I变小的主要原因是由于中和反应的发生,生成难溶于水的Ba3(PO4)2和难电离的水,使溶液中自由移动的离子浓度下降,
故答案为:生成难溶的Ba3(PO4)2和难电离的水,使溶液中的离子浓度降低.
点评:本题考查电解原理,题目侧重于酸碱混合的计算和判断,题目难度中等,注意把握参加反应的物质的量的关系,为解答该题的关键.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
硬质玻璃管是化学实验中经常使用的一种仪器,分析下列实验(固定装置略)并回答:
(1)进行微量实验:如图1所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表.
(2)如图2所示,将硬质玻璃管改装为燃烧管.挤压软塑瓶壁,向装有固体B的锥形瓶中加入溶液A,同时往燃烧管中通入气体C并点燃,可看到明显的燃烧现象(金属网用以防止气体混合爆炸).
①用此装置模拟工业合成盐酸,则关于试剂选择正确的是 (填序号),管口可观察到 色火焰.
②若溶液A为饱和食盐水,气体C为氧气,燃烧管内观察到明亮火焰与浓浓黑烟,则固体B为 (填化学式).此火焰温度极高,叫做 ,常用于切割焊接金属.

(1)进行微量实验:如图1所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表.
| 棉球 | 棉球上滴加试剂 | 实验现象 | 解释或结论 |
| a | 棉球变白, 微热后又恢复红色 |
解释: 结论:该气体具有漂白性. | |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: |
| c | 棉球变为白色 | 化学方程式: 结论:该气体具有 |
①用此装置模拟工业合成盐酸,则关于试剂选择正确的是
②若溶液A为饱和食盐水,气体C为氧气,燃烧管内观察到明亮火焰与浓浓黑烟,则固体B为
| 溶液A | 固体B | 气体C | |
| a | 稀硫酸 | Zn | Cl2 |
| b | 浓盐酸 | MnO2 | H2 |
| c | 稀硝酸 | Fe | Cl2 |
| d | 浓盐酸 | KMnO4 | H2 |

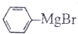 )与二苯酮反应制备三苯甲醇.
)与二苯酮反应制备三苯甲醇.