网址:http://m.1010jiajiao.com/timu_id_518089[举报]
物理部分参考答案
14.B 15. D
22.(I)(1)A (2).files/image208.gif) ;
;.files/image210.gif) B
B
II(1)
.files/image212.jpg)
(2)A1 ; R1
23.(14分)解:(1)陈若琳跃起后可看作竖直向上的匀减速运动,重心上升的高度
设起跳速度为.files/image214.gif) ,则
,则.files/image216.gif) ,上升过程的时间
,上升过程的时间.files/image218.gif)
解得.files/image220.gif) (2分)
(2分)
陈若琳从最高处自由下落到手触及水面的过程中重心下落的高度
.files/image222.gif) (2分)
(2分)
设下落过程的时间为.files/image224.gif) ,则
,则.files/image226.gif)
解得.files/image228.gif) (2分)
(2分)
陈若琳要完成一系列动作可利用的时间
.files/image230.gif) (2分)
(2分)
(2)设从最高点到水面下最低点的过程中,重力做的功为.files/image232.gif) ,克服水的作用力的功为
,克服水的作用力的功为.files/image234.gif)
由动能定理可得.files/image236.gif) (2分)
(2分)
.files/image238.gif)
24.(18分)
.files/image240.jpg) 解:(1)设杆ab刚进入半圆形导轨时速度为
解:(1)设杆ab刚进入半圆形导轨时速度为.files/image242.gif) ,到达最高位置CD位置时,速度为
,到达最高位置CD位置时,速度为.files/image244.gif) ,由于恰能通过最高点,则:
,由于恰能通过最高点,则:.files/image246.gif) 解得
解得.files/image248.gif)
杆ab进入半圆形导轨后,由于轨道绝缘,无感应电流,则根据机械能守恒:
.files/image250.gif)
解得.files/image252.gif)
设在最低点时半圆形轨道对杆ab的支持力为N,
则有.files/image254.gif)
解得
(2)杆ab离开半圆形导轨后做平抛运动,设经时间.files/image256.gif) 落到水平导轨上
落到水平导轨上
.files/image258.gif) 解得
解得.files/image260.gif)
则杆ab与NQ的水平距离.files/image262.gif)
故EF与NQ的水平距离为
(3)设杆ab做匀减速运动的加速度为a
.files/image264.gif) 解得
解得.files/image266.gif)
对杆刚要到达NQ位置进行分析
.files/image268.gif)
25.(22分)解:(1)设所加电场沿X、Y轴的分量分别.files/image270.gif) 和
和.files/image272.gif) ,粒子沿X、Y轴的加速度分量分别和
,粒子沿X、Y轴的加速度分量分别和.files/image274.gif) ,则有:
,则有:
.files/image276.gif) 代入
代入.files/image278.gif) 解得
解得.files/image280.gif)
粒子到达P点时速度为.files/image282.gif)
.files/image284.gif)
粒子的加速度为.files/image286.gif)
.files/image288.gif)
(2)设粒子在框架内的圆周运动半径为R
由分析可知.files/image290.gif) 解得:
解得:.files/image292.gif)
由.files/image294.gif)
则.files/image296.gif)
(3)设从C到P运动的时间为,碰撞次数最小的情况下在磁场中运动的周期为T
则.files/image298.gif)
.files/image300.gif)
在电场中运动的时间.files/image302.gif)
在磁场中运动的时间.files/image304.gif)
回到C点的时间.files/image306.gif)
生物部分参考答案
一、选择题:1――6 CBADBB
二、非选择题
30.I(14分除注明外,每空2分)(1)阴生 (2)6 (3)efgh (4)4 不能(1分),因为植物一昼夜积累的有机物为零(1分) (5)不正确(1分):葡萄糖不能直接进入线粒体,必须在细胞质基质中分解为丙酮酸后,方可进入线粒体继续分解(1分) (6)光能→ATP中活跃的化学能→有机物中稳定的化学能→ATP中活跃的化学能
II(14分,每空2分)
(1)①试验要有可重复性,仅用两只小白鼠进行试验有一定的偶然性;②对照试验前首先测量甲、乙两鼠的体温。③对照组要作假性试验处理(其他合理也可给分)
(2)赞同,先做不破坏下丘脑的试验,再做破坏下丘脑后的试验,进行前后自身对照。
(3)BD(不完整不得分)
(4)甲状腺素和肾上腺素(不完整不得分)神经和体液(不完整不得分)
(5)影响甲状腺素的分泌,精神萎靡,食欲不振恶或影响抗利尿激素合成,尿液量增加。(其他合理也可给分)
31.(16分,每空2分)
(1)形状分离 高产抗病且能稳定(不完整不得分)
(2)选择
(3)不同物种间存在生殖隔离(或远源杂交不亲和的障碍)
(4)①1:1 ②抗性小麦:不抗性小麦=3:1 (不完整不得分) ③抗病基因接在含有高产基因的染色体上
(5)病原体感染
化学部分答案
7-13 BADBCCC
26.(共16分)
I (1).files/image308.jpg) (1分) ;(2)弱 (1分) ;只要符合要求即可 (2分)
(1分) ;(2)弱 (1分) ;只要符合要求即可 (2分)
(3)N2H4(1)+O2(g)=N2(g)+2H2O(1),.files/image310.gif) H=-629Kj/mol (3分)
H=-629Kj/mol (3分)
II (1)无论从速率还是平衡考虑,压强越大均越有利,但考虑到设备材质和加工工艺要求、生产力等综合成本等因素,实际采用30―50Mpa ,(2分)
在此温度范围内,催化剂活性最佳。(2分)
(2).files/image312.gif) (2分) (3)N2+6e-+8H+=2N
(2分) (3)N2+6e-+8H+=2N.files/image314.gif) (3分)
(3分)
27.(共14分)
(1).files/image316.jpg)
(2)氯碱工业
(1分) ,.files/image318.gif) (3分)
(3分)
(3).files/image320.gif) (2分)
(2分) .files/image322.gif) (2分) (4)
(2分) (4).files/image324.gif) (3分)
(3分)
28.(共14分)
(1)+1价, +2价, (各1分); Cu2O(2分)
(2)阴极上:.files/image326.gif) (2分)
(2分)
阳极上:.files/image328.gif) (白)(3分)
(白)(3分)
(3)①.files/image330.gif) (3分)
(3分)
②.files/image332.gif) (2分)
(2分)
29.(共14分)
(1)①②④ (2分)
(2)1,2-二溴丙烷(2分)
.files/image334.jpg) www.ks5u.com
www.ks5u.com
CO2是目前大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。
(1)其中一种途径是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)===C2 H4(g)+3O2(g) △H=十1411.0kJ/mol
2CO2(g) +3H2 O(l)=C2 H5OH(1)十3O2(g)△H = +1366.8kJ/mol
则由乙烯水化制乙醇反应的热化学方程式为 。
(2)在一定条件下,6H2(g)+2CO2(g) CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。
 温度(K) 温度(K)CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
①温度一定时,提高氢碳比[著轰击],CO2的转化率 (填“增大”“减小”
“不变”)。
②该反应的正反应为 (填“吸”或“放”)热反应。
(3)定条件下,将3 molH2和1molCO2两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3H2(g)+CO2(g)
 CH3OH(g)+H2O(g)。2min末该反应达到平衡,测得CH30H的浓度为0.2mol/L。下列判断不正确的是___ _。
CH3OH(g)+H2O(g)。2min末该反应达到平衡,测得CH30H的浓度为0.2mol/L。下列判断不正确的是___ _。a.该条件下此反应的化学平衡常数表达式为
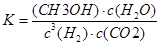
b.H2的平均反应速率为0.3mol/(L.s)
c.CO2的转化率为60%
d.若混合气体的密度不再改变时,该反应一定达到平衡状态
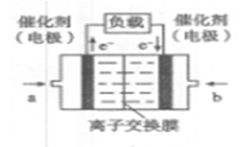
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是 (填“乙醇”或“氧气”),b处电极上发生的电极反应是: 。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其
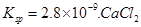 溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为
溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为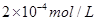 ,则生成沉淀所需CaCl2溶液的最小浓度为 。
查看习题详情和答案>>
,则生成沉淀所需CaCl2溶液的最小浓度为 。
查看习题详情和答案>>
(1)其中一种途径是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)===C2 H4(g)+3O2(g) △H=十1411.0kJ/mol
2CO2(g) +3H2 O(l)=C2 H5OH(1)十3O2(g)△H = +1366.8kJ/mol
则由乙烯水化制乙醇反应的热化学方程式为 。
(2)在一定条件下,6H2(g)+2CO2(g)
 CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。 温度(K) 温度(K)CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
①温度一定时,提高氢碳比[著轰击],CO2的转化率 (填“增大”“减小”
“不变”)。
②该反应的正反应为 (填“吸”或“放”)热反应。
(3)定条件下,将3 molH2和1molCO2两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3H2(g)+CO2(g)
 CH3OH(g)+H2O(g)。2min末该反应达到平衡,测得CH30H的浓度为0.2mol/L。下列判断不正确的是___ _。
CH3OH(g)+H2O(g)。2min末该反应达到平衡,测得CH30H的浓度为0.2mol/L。下列判断不正确的是___ _。a.该条件下此反应的化学平衡常数表达式为

b.H2的平均反应速率为0.3mol/(L.s)
c.CO2的转化率为60%
d.若混合气体的密度不再改变时,该反应一定达到平衡状态
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是 (填“乙醇”或“氧气”),b处电极上发生的电极反应是: 。

(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其
 溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为
溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为 ,则生成沉淀所需CaCl2溶液的最小浓度为 。
,则生成沉淀所需CaCl2溶液的最小浓度为 。| 元素 | 相关信息 |
| X | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
| Y | 地壳中含量最高的元素 |
| Z | 存在质量数为23,中子数为11的核素 |
| W | 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质 |
| R | 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(2)X与氢两元素按原子数目比1:3和2:4构成分子A和B,A的结构式为




(3)砷(As)是人体必需的微量元素,与X同一主族,As原子比X原子多两个电子层,则砷的原子序数为
(4)用RCl3溶液腐蚀铜线路板的离子方程式为
(5)Z-W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成.该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2═17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0mol/L HCl溶液中能完全释放出H2.1mol Zl7W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为
(16分)实验室有NH4HCO3和NaHSO3的干燥粉状混合物,某兴趣小组为测定其中NH4HCO3的含量,设计了用在混合物中加酸的实验方法来测定其质量分数。回答以下问题:
⑴化学小组主要选用了下列药品和仪器进行实验。(图中每种仪器装置只选用了一次,铁架台等固定仪器未画出)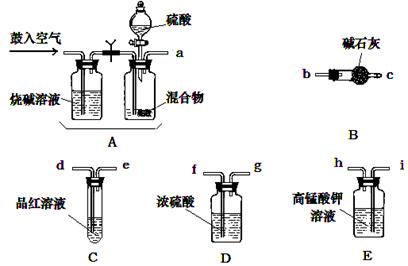
请按气流由左向右的方向,仪器连接顺序是(填仪器的接口字母a、b...)
a→ → → → → f →g → → 。
⑵实验开始,混合物加酸前,A装置需要鼓入空气,作用是 ;加酸后A装置再次鼓入空气的作用是 。
⑶ E装置的作用是 。
⑷实验中,若C瓶中溶液褪色,则测定结果可能会偏 (填“高”或“低”)。为了确
保实验中C瓶溶液不褪色,若取样品的质量为m g,实验前 E中所装 a mol·L-1的KMnO4
溶液体积(V)不少于 mL。
⑸若混合物样品质量为13.1g,充分作用后碱石灰增重4.4g,则混合物中NH4HCO3的质
量分数为 。
⑹从定量测定的准确性考虑,该套装置还应作进一步的改进是 。
可能用到的相对原子质量:H~1 C~12 N~14 O~16 Na~23 S~32
(16分)实验室有NH4HCO3和NaHSO3的干燥粉状混合物,某兴趣小组为测定其中NH4HCO3的含量,设计了用在混合物中加酸的实验方法来测定其质量分数。回答以下问题:
⑴ 化学小组主要选用了下列药品和仪器进行实验。(图中每种仪器装置只选用了一次,铁架台等固定仪器未画出)

请按气流由左向右的方向,仪器连接顺序是(填仪器的接口字母a、b...)
a→ → → → → f →g → → 。
⑵ 实验开始,混合物加酸前,A装置需要鼓入空气,作用是 ;加酸后A装置再次鼓入空气的作用是 。
⑶ E装置的作用是 。
⑷ 实验中,若C瓶中溶液褪色,则测定结果可能会偏 (填“高”或“低”)。为了确
保实验中C瓶溶液不褪色,若取样品的质量为m g,实验前 E中所装 a mol·L-1的KMnO4
溶液体积(V)不少于 mL。
⑸ 若混合物样品质量为13.1 g,充分作用后碱石灰增重4.4 g,则混合物中NH4HCO3的质
量分数为 。
⑹ 从定量测定的准确性考虑,该套装置还应作进一步的改进是 。
可能用到的相对原子质量:H~1 C~12 N~14 O~16 Na~23 S~32
查看习题详情和答案>>