题目内容
CO2是目前大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。
(1)其中一种途径是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)===C2 H4(g)+3O2(g) △H=十1411.0kJ/mol
2CO2(g) +3H2 O(l)=C2 H5OH(1)十3O2(g)△H = +1366.8kJ/mol
则由乙烯水化制乙醇反应的热化学方程式为 。
(2)在一定条件下,6H2(g)+2CO2(g) CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。
根据上表中数据分析:
①温度一定时,提高氢碳比[著轰击],CO2的转化率 (填“增大”“减小”
“不变”)。
②该反应的正反应为 (填“吸”或“放”)热反应。
(3)定条件下,将3 molH2和1molCO2两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3H2(g)+CO2(g) CH3OH(g)+H2O(g)。2min末该反应达到平衡,测得CH30H的浓度为0.2mol/L。下列判断不正确的是___ _。
CH3OH(g)+H2O(g)。2min末该反应达到平衡,测得CH30H的浓度为0.2mol/L。下列判断不正确的是___ _。
a.该条件下此反应的化学平衡常数表达式为

b.H2的平均反应速率为0.3mol/(L.s)
c.CO2的转化率为60%
d.若混合气体的密度不再改变时,该反应一定达到平衡状态
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是 (填“乙醇”或“氧气”),b处电极上发生的电极反应是: 。

(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其 溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为
溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为 ,则生成沉淀所需CaCl2溶液的最小浓度为 。
,则生成沉淀所需CaCl2溶液的最小浓度为 。
(1)其中一种途径是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)===C2 H4(g)+3O2(g) △H=十1411.0kJ/mol
2CO2(g) +3H2 O(l)=C2 H5OH(1)十3O2(g)△H = +1366.8kJ/mol
则由乙烯水化制乙醇反应的热化学方程式为 。
(2)在一定条件下,6H2(g)+2CO2(g)
 CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。 温度(K) 温度(K)CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
①温度一定时,提高氢碳比[著轰击],CO2的转化率 (填“增大”“减小”
“不变”)。
②该反应的正反应为 (填“吸”或“放”)热反应。
(3)定条件下,将3 molH2和1molCO2两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3H2(g)+CO2(g)
 CH3OH(g)+H2O(g)。2min末该反应达到平衡,测得CH30H的浓度为0.2mol/L。下列判断不正确的是___ _。
CH3OH(g)+H2O(g)。2min末该反应达到平衡,测得CH30H的浓度为0.2mol/L。下列判断不正确的是___ _。a.该条件下此反应的化学平衡常数表达式为

b.H2的平均反应速率为0.3mol/(L.s)
c.CO2的转化率为60%
d.若混合气体的密度不再改变时,该反应一定达到平衡状态
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是 (填“乙醇”或“氧气”),b处电极上发生的电极反应是: 。

(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其
 溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为
溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为 ,则生成沉淀所需CaCl2溶液的最小浓度为 。
,则生成沉淀所需CaCl2溶液的最小浓度为 。
⑴2CO2(g)+2H2O(l)===C2 H4(g)+3O2(g) △H=十1411.0kJ/mol①
2CO2(g) +3H2 O(l)=C2 H5OH(1)十3O2(g)△H = +1366.8kJ/mol②
①-②得
C2H4(g)+H2O(l)=C2H5OH(l) △H=―44.2kJ/mol
⑵由表中看出,温度一定时,提高氢碳比[著轰击],CO2的转化率①增大;氢碳比一定,提高温度,CO2的转化率,平衡逆向移动,正确反应②放热;
⑶bcd
3H2(g)+CO2(g)
 CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。c始 1.5 0.5
c变 0.6 0.2 0.2 0.2
c平 0.9 0.3 0.2 0.2
a.正确;
b.不正确, H2的平均反应速率为0.3mol/(L.min)
c.不正确,CO2的转化率为0.2/0.5×100%=40%
d.不正确,混合气体的密度始终不变;
⑷a是电池的负极,原料是乙醇,O2+4e-+2H2O=4OH―
⑸2×2.8×10―9/1×10―4=5.6×10―5mol/L

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
 恒容时,升高温度,混合气体的颜色加深,下列说法正确的是
恒容时,升高温度,混合气体的颜色加深,下列说法正确的是 ,2分钟末反应达到平衡状态,生成了0.8mol D,请填写下面空白:
,2分钟末反应达到平衡状态,生成了0.8mol D,请填写下面空白:
 HCl + HClO,当加入AgNO3溶液后,溶液颜色变浅
HCl + HClO,当加入AgNO3溶液后,溶液颜色变浅 H2(g)+I2(g),平衡体系增大压强可使颜色变深
H2(g)+I2(g),平衡体系增大压强可使颜色变深 CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动
CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动 2NH3;DH<0)
2NH3;DH<0) CO2(g)+H2 (g) △H<0
CO2(g)+H2 (g) △H<0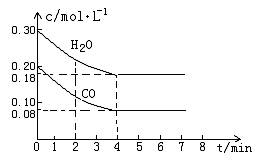

 溶液中c(SO42-)一定等于3´10-3 mol·L—1
溶液中c(SO42-)一定等于3´10-3 mol·L—1 2(g);
2(g);