摘要:[答案](1)Zn-2e-=Zn2+ 2MnO2+H2=Mn2O3+H2O(3)①向黑色粉末中加入一定量的蒸馏水充分搅拌溶解.过滤.将滤液蒸发浓缩.冷却结晶.再过滤.所得晶体即为ZnCl2和NH4Cl的混合物②加法③取少量ZnCl2于试管中溶解.将溶液平均分为两等份.分别滴加足量NaOH溶液和氨水.两支试管中均为先后白色沉淀生成.后沉淀又溶解
网址:http://m.1010jiajiao.com/timu_id_516126[举报]
日常所用干电池其电极分别为碳棒(上面有铜帽)和锌皮,以糊状NH4Cl和ZnCl2作电解质(其中加入MnO2吸收H2),电极反应可简化为:Zn-2e- Zn2+,2
Zn2+,2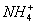 +2e-
+2e- 2NH3+H2(NH3与Zn2+络合)。根据以上叙述判断下列结论正确的是( )
2NH3+H2(NH3与Zn2+络合)。根据以上叙述判断下列结论正确的是( )
A.Zn为正极,碳为负极
B.Zn为负极,碳为正极
C.工作时电子由碳极,经外电路流向Zn极
D.长时间连续使用时内装糊状物可能流出腐蚀用电器
查看习题详情和答案>>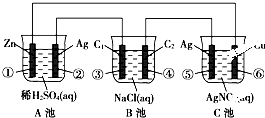 已知金属活动相差越大,形成原电池时越容易放电.请根据如图装置,回答下列问题:
已知金属活动相差越大,形成原电池时越容易放电.请根据如图装置,回答下列问题:(1)各装置名称是:A池
原电池
原电池
,B池电解池
电解池
.(2)写出电极上发生的反应:①
Zn-2e-=Zn2+
Zn-2e-=Zn2+
,③2Cl--2e-=Cl2↑
2Cl--2e-=Cl2↑
.(3)当电路上有1mol电子流过时,⑥极上质量变化
108
108
g.(1)某化学反应,设反应物总能量为E1,生成物总能量为E2.若E1>E2,则该反应为
(2)用锌片、铜片和稀盐酸组成的原电池,正极的电极反应是
查看习题详情和答案>>
放
放
热反应,该反应的能量转化是 化学能转化为热能化学能转化为热能
化学能转化为热能
.(2)用锌片、铜片和稀盐酸组成的原电池,正极的电极反应是
2H++2e-=H2↑;
2H++2e-=H2↑;
,负极的电极反应是Zn-2e-=Zn2+;
Zn-2e-=Zn2+;
,原电池反应是Zn+2H+-=Zn2++H2↑
Zn+2H+-=Zn2++H2↑
.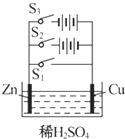 根据右图,回答下列问题:
根据右图,回答下列问题: 在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如图:
在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如图: