题目内容
 在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如图:
在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如图:(1)如果把电键K接A,这一装置形成
电解池
电解池
装置,Zn(1)极是阳
阳
极,其电极反应式是Zn-2e-=Zn2+
Zn-2e-=Zn2+
.(2)上述反应进行5min后,转换电键K到C,这一装置形成
原电池
原电池
装置,Zn(1)极是负
负
极,该装置发生反应的总化学方程式是Zn+CuCl2=ZnCl2+Cu
Zn+CuCl2=ZnCl2+Cu
;(3)上述装置进行2min后,再转换电键K到B,在Zn(2)极上发生的腐蚀属于
电化学
电化学
腐蚀(填“化学”或“电化学”),被腐蚀的金属是Zn
Zn
.分析:(1)由图可知,为电解装置,Zn(1)与正极相连为阳极,发生氧化反应;
(2)反应进行5min后,转换电键K到C,为原电池装置,Zn(1)为负极,发生Zn置换Cu的反应;
(3)进行2min后,再转换电键K到B,Zn(2)极上Cu、Zn及电解质形成原电池,Zn被腐蚀.
(2)反应进行5min后,转换电键K到C,为原电池装置,Zn(1)为负极,发生Zn置换Cu的反应;
(3)进行2min后,再转换电键K到B,Zn(2)极上Cu、Zn及电解质形成原电池,Zn被腐蚀.
解答:解:(1)由图可知,为电解装置,Zn(1)与正极相连为阳极,发生氧化反应,电极反应为Zn-2e-=Zn2+,故答案为:电解池;阳;Zn-2e-=Zn2+;
(2)反应进行5min后,转换电键K到C,为原电池装置,Zn(1)为负极,发生Zn置换Cu的反应,该电池反应为Zn+CuCl2=ZnCl2+Cu,
故答案为:原电池;负;Zn+CuCl2=ZnCl2+Cu;
(3)进行2min后,再转换电键K到B,Zn(2)极上Cu、Zn及电解质形成原电池,为电化学腐蚀,Zn活泼,作负极,所以Zn被腐蚀,故答案为:电化学;Zn.
(2)反应进行5min后,转换电键K到C,为原电池装置,Zn(1)为负极,发生Zn置换Cu的反应,该电池反应为Zn+CuCl2=ZnCl2+Cu,
故答案为:原电池;负;Zn+CuCl2=ZnCl2+Cu;
(3)进行2min后,再转换电键K到B,Zn(2)极上Cu、Zn及电解质形成原电池,为电化学腐蚀,Zn活泼,作负极,所以Zn被腐蚀,故答案为:电化学;Zn.
点评:本题考查原电池和电解质,侧重装置的分析及原理的考查,注意开关K的位置变化及发生的反应是解答的关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
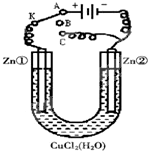 在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,如图所示
在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,如图所示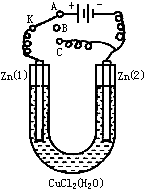 在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如图:
在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如图: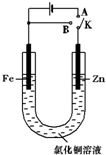 在一个U形管里盛有氯化铜溶液,按图连接.
在一个U形管里盛有氯化铜溶液,按图连接.